Bastonetes e cones mineralizados sugerem visão de cores em um peixe fóssil de 300 milhões de anos
Nature Communications volume 5 , número do artigo: 5920 ( 2014 )
Resumo
A visão, que consiste em um sistema óptico, receptores e capacidade de processamento de imagem, existe há pelo menos 520 milhões de anos. Exceto pelo sistema óptico, como nas lentes calcificadas dos artrópodes trilobitas e ostracodes, outras partes do sistema visual geralmente não são preservadas no registro fóssil, porque os tecidos moles do olho e do cérebro decaem rapidamente após a morte, como no interior. 64 dias e 11 dias, respectivamente. A Formação Hamilton do Carbonífero Superior (300 Myr) no Kansas, EUA, produz fósseis de animais excepcionalmente bem preservados em um ambiente deposicional estuarino. Aqui mostramos que a cor original, a forma e a presença putativa da eumelanina foram preservadas no peixe acanthodii Acanthodes bridgei . Também relatamos os tecidos de seu olho, que fornece o primeiro registro de bastonetes e cones mineralizados em um fóssil e indica que esse peixe de 300 milhões de anos provavelmente possuía visão de cores.
Introduction
A evolução da visão em vertebrados é um tema importante na história da vida animal. O mais antigo suposto vertebrado conhecido, Myllokunmingia do início do Cambriano Chengjiang Biota 1 , 2 , 3 , 4 , 5 (~520 Myr), supostamente possuía um olho rudimentar do tipo câmera, mas sua ultraestrutura é desconhecida. Os vertebrados conodontes também apareceram pela primeira vez no Cambriano e presume-se que tenham olhos grandes 6 . Exceto pelo sistema óptico, como nas lentes calcificadas dos artrópodes trilobitas e ostracodes, outras partes do sistema visual geralmente não são preservadas no registro fóssil, porque os tecidos moles do olho e do cérebro decaem rapidamente após a morte, como no interior. 64 dias e 11 dias, respectivamente 7 . Apenas cinco estudos relataram um receptor visual fossilizado 8 , 9 , 10 , 11 ou um molde equivalente 12 , todos envolvendo olhos de artrópodes. A falta de preservação do receptor em olhos fossilizados de vertebrados limitou sua comparação com os olhos de parentes existentes. Opsinas são as moléculas nas retinas existentes que são responsáveis pela visão de cores. Análises filogenéticas moleculares sugerem que quatro das cinco classes de genes de opsinas de vertebrados e, portanto, visão de cores, já existiam no início do Cambriano. 13 , 14 . Embora tenha sido sugerido que pigmentos produtores de cor tenham sido preservados nas partes externas de alguns fósseis de vertebrados mesozóicos 15 , 16 , 17 , 18 , 19 , 20 , fornecendo algumas evidências de que os vertebrados foram adaptados à cor em tempos geológicos passados, até agora tem havido nenhuma evidência direta de receptores sensíveis à cor em vertebrados fósseis. Nós aqui relatamos os tecidos do olho do peixe acanthodii Acanthodes bridgei , que fornece o primeiro registro de bastonetes e cones em um fóssil e indica que os peixes provavelmente possuíam visão de cores por pelo menos 300 milhões de anos.
Resultados
Morphology of granules
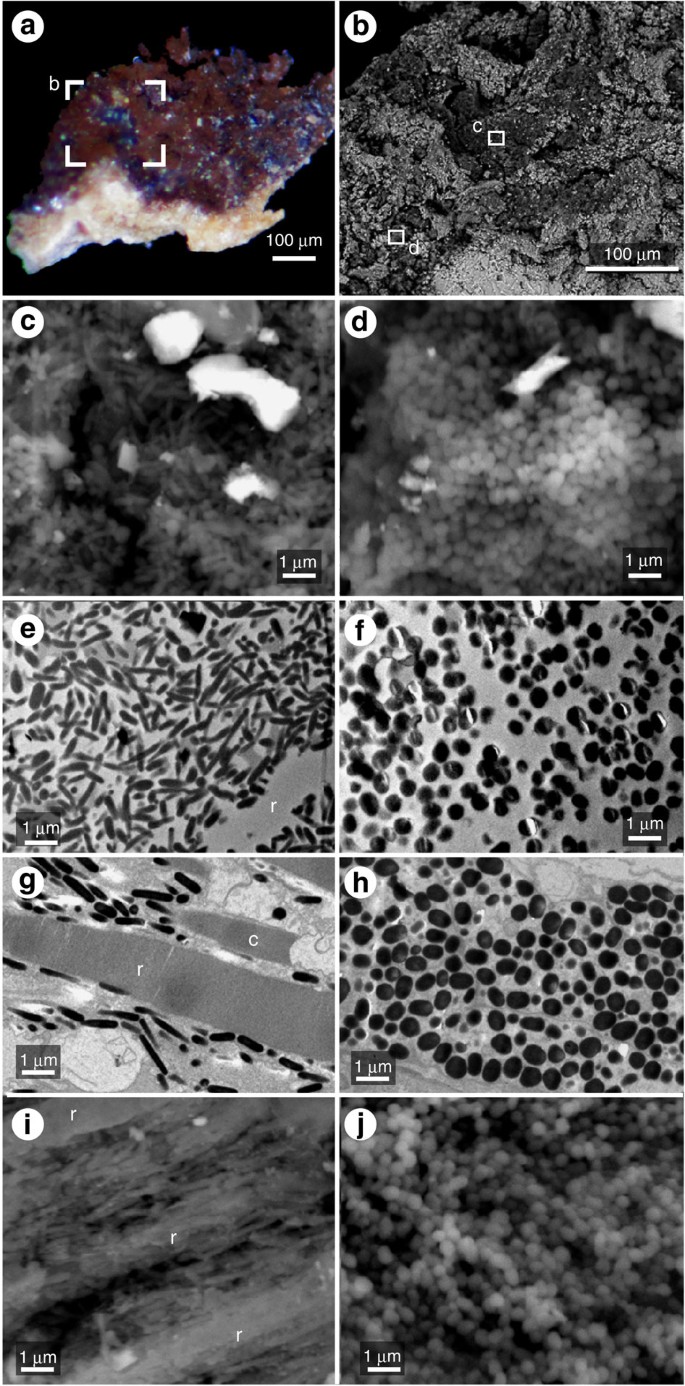
Fossils of the acanthodian fish A. bridgei from the Upper Carboniferous Hamilton formation of Kansas show extremely well-preserved skin and articulated cartilages21,22,23. The eyes reveal black and/or dark brown material surrounded by four pieces of sclera skeletal support (Fig. 1). Scanning and transmission electron microscopy (SEM and TEM) confirm observations that many elongate, spindle-shaped granules 1–1.5 μm long (Fig. 2c,e) and spherical granules with a diameter <1 μm (Fig. 2d,f) occur in the dark brown area of the eye (Figs 1 and 2a). The granule area is clearly distinguished from the surrounding limestone matrix area, which has smooth, carbonate crystals (Supplementary Fig. 1). The granules have the same size and shape as the eumelanin granules in the eye of the extant freshwater fish Rhinogobius sp. (Fig. 2g–j).
digital (DM), SEM e TEM de um olho de A. bridgei ( a – f , NSM PV22246, 22247), e TEM do olho de Rhinogobius ( g – j , NSM PV22248). ( a ) DM de pequena área de olho preto e/ou marrom (NSM PV22246). ( b ) SEM da parte ampliada da Fig. 2a . ( c ) SEM de uma pequena região de b mostrando muitos grânulos alongados em forma de fuso. ( d ) SEM de uma pequena região de b mostrando grânulos esféricos encontrados na área inferior direita. ( e ) TEM mostrando muitos grânulos alongados em forma de fuso no fóssil A. bridgei (NSM PV22247). ( f ) TEM mostrando muitos grânulos esféricos no fóssil A. bridgei (NSM PV22247). ( g ) TEM da eumelanina encontrada em Rhinogobius , entre a haste (r) e o cone (c). ( h ) TEM de melanossomas do epitélio pigmentar da retina (EPR) na base do olho no Rhinogobius . ( i ) SEM de eumelaninas entre os bastonetes (r) em Rhinogobius . ( j ) SEM de melanossomas RPE em Rhinogobius .
Chemical data
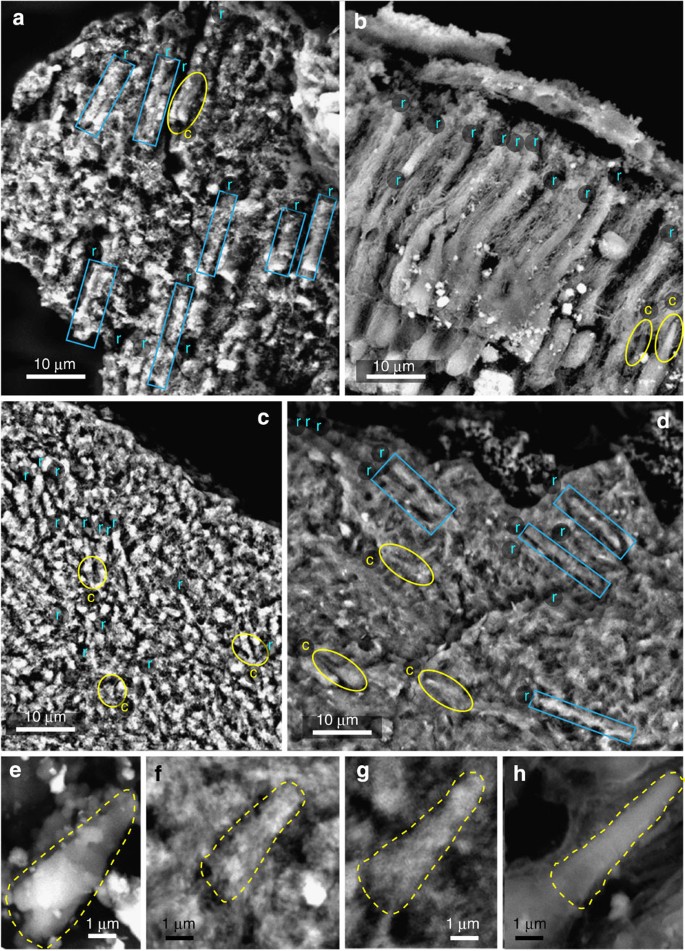
Os resultados analíticos usando oxidação alcalina de peróxido de hidrogênio revelaram que altas concentrações de ácido pirrol-2,3,5-tricarboxílico (PTCA), ácido pirrol-2,3-dicarboxílico (PDCA) e pirrol-2,3,4,5-tetracarboxílico ácido (PTeCA) ocorreu nos fragmentos castanhos escuros do olho fóssil, mas estava ausente na matriz rochosa ( Tabela 1 ). Essas moléculas são comuns apenas à eumelanina e nunca foram produzidas pela oxidação alcalina do peróxido de hidrogênio de qualquer outro material biológico 24 , 25 , 26 . A razão PTeCA/PTCA de 2,7 é extremamente alta em comparação com as da retina de peixe existente (0,10 na Tabela 1 ) e melanossomas do epitélio pigmentar da retina bovina (0,13), indicando extensa modificação térmica da eumelanina 26 , 27 . A área da retina de A. bridgei tem muitos bastonetes mineralizados, cada um com cerca de 2 μm de largura e comprimento máximo de cerca de 18 μm ( Fig. 3a,c,d ). Nenhuma imunorreatividade para rodopsina foi observada na retina fóssil ( Fig. Suplementar 2a-d ). Por outro lado, as estruturas semelhantes a bastonetes na retina de góbios de lagartos vivos mostraram imunorreatividade para rodopsina. Fig. 2e,f suplementar ). Esses resultados sugerem que a rodopsina, um pigmento visual nas células visuais, não está preservada na retina fóssil.
A. bridgei ( a , NSM PV22249; c – g , NSM PV22250), e SEM e TEM do olho do peixe existente Rhinogobius sp. ( b , h ). ( a – d ) SEM de um feixe de hastes (r) e cones (c). ( e – h ) SEM de um cone. Cada área da linha amarela (interrompida) e da linha azul (sólida) mostra cones e bastonetes, respectivamente.
Morfologia da retina fóssil
Devido à presença de matriz consolidada na retina fóssil, os bastonetes fragmentaram-se durante o processo de corte para observação de TEM e, portanto, não estão bem preservados quando comparados com seus equivalentes em Rhinogobius sp. Os cones mineralizados têm uma largura basal de cerca de 2 μm, uma altura de cerca de 8 μm ( Fig. 3a,c–g ) e sua forma, bem como tamanho, é comparável à dos cones de Rhinogobius sp. ( Fig. 3b,h ).
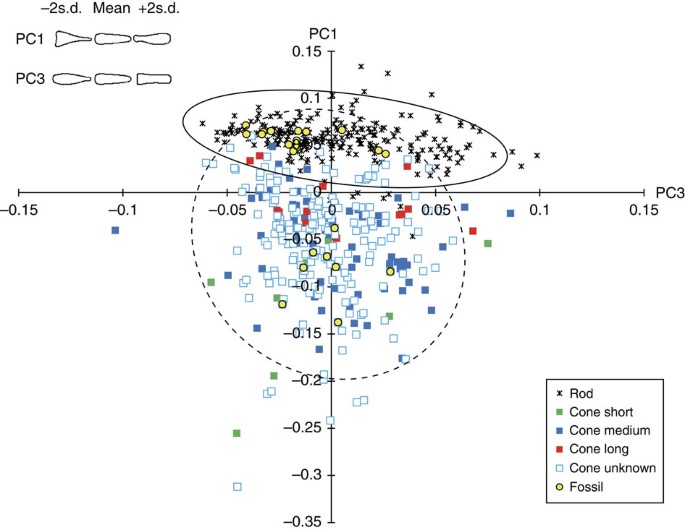
Para extrair os dois caracteres principais que determinam a morfologia dos bastonetes e cones, e para determinar a distribuição de bastonetes e cones dentro do morfoespaço bidimensional, a análise de componentes principais (PCA) usando descritores elípticos de Fourier foi realizada em 509 células da retina, incluindo o bastonetes e cones de vertebrados existentes e A. bridgei . Esta análise revelou que o primeiro componente principal (PC1) e o terceiro componente principal (PC3) são responsáveis pela largura relativa da parte distal das células da retina ( Conjuntos de Dados Suplementares 1 e 2 ). Os bastonetes e cones existentes estão amplamente espalhados das regiões de pontuação negativa para positiva de PC1, embora os cones tendam a ser distribuídos na região de pontuação mais positiva ( Fig. 4 ). Entre 14 fotorreceptores de A. bridgei , 8 espécimes plotados na região de cones em animais existentes ( Fig. 4 ). Assim, A. bridgei provavelmente tinha cones, o que sugere que os peixes possuem visão de cores por pelo menos 300 milhões de anos.
Discussão
This is the first discovery of fossil rods and cones in general and, ipso facto, also the first record of receptors, in a fossil vertebrate eye. These findings indicate that such receptors have been conserved in vertebrate eyes for at least 300 Myr. Further, the presence of cones indicates that A. bridgei likely possessed colour vision, although conclusive evidence would require the recovery of opsins. A. bridgei, like Rhinogobius today, inhabited shallow water22 that would have contained at least most of the wavelengths visible to humans from sunlight. Further, the present study shows that the original colour, shape and putative presence of eumelanin have been conserved for at least 300 Myr, 100 Myr older than previously known28. The function of retinal pigment is light absorption29. Retinal pigment is contained within the rod and cone cells. However, the retinal pigment epithelium has many functions, such as light absorption, epithelial transport (glucose, vitamin A, Cl−, H2O, K+), 11-cis retinal visual cycle, phagocytosis and secretion (pigment epithelium-derived factor and vascular endothelial growth factor)29 . O pigmento melanina na retina de vertebrados existentes realiza movimentos altamente coordenados com os movimentos retinomotores 30 , 31 , 32 . A existência de bastonetes, cones e pigmentos de melanina no olho de A. bridgei sugere que a atividade retinomotora (dois modos de visão: visão diurna por cones e visão crepuscular por bastonetes muito mais sensíveis) provavelmente já existia há 300 milhões de anos. A. bridgei supostamente vivia em águas salobras bastante rasas 22 . Além disso, as proporções cone:bastonete de A. bridgei são comparáveis com a de Rhinogobius ( Fig. 3c,d ), indicando que o peixe fóssil era diurno e dependia da visão 33 . Esses resultados sugerem fortemente que A. bridgei, o último ancestral comum dos gnatostomados modernos 34 , possuía visão de cores, embora evidências conclusivas exigiriam a recuperação de opsinas.
Methods
SEM and TEM observations
Fragmentos de retina alavancados do fóssil foram colocados em um stub e vistos sob um microscópio óptico estereoscópico (Nikon SMZ-U) e observados sob um SEM (HITACHI TM-1000, TM-3000) sem revestimento sob baixo vácuo no Museu Gunma de História Natural (GMNH) e Agência Japonesa para Ciência e Tecnologia da Terra Marinha (JAMSTEC). Um fragmento de retina foi fixado durante a noite em glutaraldeído a 2% com formaldeído a 2% em tampão cacodilato de sódio 0,1 M (pH 7,4). O espécime foi enviado para a Faculdade de Medicina da Universidade de Okayama e descalcificado com EDTA-2Na 10% (pH 7,4) por ~20 h e pós-fixado em tetróxido de ósmio 2% por ~2,5 h, desidratado através de uma série de etanol e incorporado em Spurr's resina e polimerizado. Cortes finos foram obtidos em ultramicrótomo, corados com 2% de acetato de uranila com 50% de etanol e citrato de chumbo e examinados em TEM (Hitachi H-7650). O peixe vivo de água doce, Rhinogobius sp. (comprimento do corpo de 4,5 cm), foi selecionado para fins comparativos porque o peixe fóssil acantódico está mais relacionado aos peixes actinopterígios do que aos tubarões condrichthyes 35 ou o último ancestral comum dos gnatostomados modernos 34 . Além disso, o Rhinogobius vive em águas salobras bastante rasas 22 e tem comprimento de corpo e tamanho de olho semelhantes ao do peixe fóssil. O espécime foi capturado usando uma cesta de rede em um pequeno lago próximo ao GMNH e foi fixado com glutaraldeído 2,5%. Seu globo ocular foi removido e fixado por ~2,5 h, e então clivado por bisturi cirúrgico enquanto estava dentro da solução de glutaraldeído. O espécime foi transferido para o Centro de Pesquisa em Ciências Humanas e Ambientais da Universidade de Shinshu a uma temperatura de 4°C. O espécime foi lavado com tampão cacodilato de sódio 0,1 M (pH 7,4) e pós-fixado em tetróxido de ósmio a 1% por 1 h a 0 °C, depois desidratado através de uma série de etanol e incorporado em resina Epon e polimerizado. Cortes finos foram obtidos usando um ultramicrótomo e depois corados com acetato de uranila e citrato de chumbo e examinados sob um TEM (JEOL JEM-1400HC).
Chemical analyses
To identify the presence of melanin in the fossil material, the alkaline hydrogen peroxide oxidation method24,25,26,27 was used in the black to dark brown-coloured fossil eye fragments and the light brown-coloured rock matrix.
Amostras (8–17 mg) foram moídas em pó fino com almofariz e pilão e adicionadas à água na concentração de 10 mg por ml de água e alíquotas de 100 μl foram submetidas à oxidação alcalina do peróxido de hidrogênio 25 . PTCA e PDCA foram analisados pelas condições de cromatografia líquida de alta eficiência (HPLC) descritas anteriormente 25 usando tampão fosfato de potássio 0,1 M (pH 2,1): metanol = 99:1, e PTeCA e PTCA foram analisados pelas condições de HPLC 26 usando 0,1 M tampão fosfato de potássio (pH 2,1): metanol = 88:15. Dois testes separados foram realizados para fragmentos de olhos fósseis e fragmentos de matriz de rocha, respectivamente. Para comparar com os dados de peixes fósseis, pigmento retinal liofilizado de Rhinogobius sp. (0,39 mg) foi analisado com os mesmos métodos.
Análise morfológica de bastonetes e cones
Generally speaking, the external contours of the rods and cones have been qualitatively described as rectangular and triangular, respectively. However, the contours of the cones vary from an elongated trapezoid to an equilateral triangle36. To describe the contour of the rods and cones quantitatively, an elliptic Fourier analysis was carried out using SHAPE freeware37. Images of each rod and cone obtained from the literature (Supplementary Data Set 1; Supplementary Note 1) were saved as a RGB bitmap file and converted into a binary image using SHAPE. Subsequently, image noise was manually removed using graphics software (Adobe Photoshop, version 7.01) to obtain an image of only the contour of each rod and cone. The chain-code information (Supplementary Data Set 2) for contour data was normalized and converted to the first 20 harmonics of Fourier coefficients. For the analysis, elliptic Fourier coefficients were normalized for size and alignment of the major axis of the ellipse described by the first harmonic38 . Como a análise elíptica de Fourier produz quatro coeficientes por harmônico, um total de 77 coeficientes de Fourier foram obtidos. PCA foi usado para resumir os coeficientes para as 509 células da retina estudadas usando software complementar em SHAPE.
The PCA was based on the variance–covariance matrix of the coefficients because the primary focus of the present study was variation in gross rod or cone features, rather than fine structure. Geometric interpretation for each principal component was assessed from the reconstructed contours using inverse Fourier transforms. To visualize variation along a principal component axis, inverse Fourier transforms were calculated for mean±2s.d. of the PC scores, with the remaining components set to 0 (ref. 39).
Immunostaining analysis
To examine the preservation of visual pigments in the fossil retina, the specimens were immunostained for rhodopsin, which is a visual pigment of rods.
The specimens were thoroughly washed in phosphate buffered saline (PBS, pH 7.4), preincubated by immersion in a blocking solution (PBS containing 5% donkey serum, 0.1% Triton X-100 and 0.05% Tween 20) for 1 h at room temperature, then incubated with a mouse anti-rhodopsin monoclonal antibody (1:500, SMC-176C/D, Stress Marq, Victoria, Canada), which was raised against bovine rhodopsin, overnight at 4 °C in a 96-well plate. After washing in PBS, the specimens were incubated with goat anti-mouse IgG antibody conjugated with Cy3 (1:500, 115-165-003, Jackson, West Grove, PA) together with 4,6-diamidino-2-phenylindole (DAPI, 1:1,000, D9542, Sigma, St. Louis, MO) for 2 h at room temperature. After washing in PBS, the specimens were placed on glass slides, mounted with a medium (Fluoromount, K024, Diagnostic BioSystems, Pleasanton, CA) and coverslipped. For positive control, the retinas of the extant river lizard gobies (Rhinogobius sp.) were also immunostained for rhodopsin in parallel with the fossil specimens. The gobies were collected from Kamo River in Hiroshima Prefecture, Japan, and kept in tapped water tanks in the laboratory (24 °C) for at least 1 week before use. Because acclimation to darkness is known to facilitate the cleavage of the pigment epithelium layer from the layer of rods and cones in fish retina, the gobies were kept in tap water in dark conditions for at least 1 h and then anaesthetized deeply by adding a 3-ml of tricaine methanesulfonate (50 mg ml−1, MS-222, E10521, Sigma) into water. The eyeballs were immediately isolated and immersed in 4% paraformaldehyde in 0.1 M phosphate buffer (pH 7.4) for 3 h at 4 °C. The eyeballs were transferred to PBS, then under a binocular stereoscope (SZ61, Olympus, Tokyo, Japan) the pigment epithelium layer was carefully removed by tweezers to expose the layer of rods and cones. The retina was dissected into small pieces (~2 × 2 mm) to obtain the specimen for rhodopsin immunohistochemistry. The specimens were processed using the same procedures as used for immunostaining for rhodopsin in the fossil specimen. Each specimen was examined and photographed under a fluorescent microscope (BX 51, Olympus) equipped with a digital camera (DP 73, Olympus) and analysed using the software ‘cell Sens’ (Olympus). No immunoreactivity was observed in the absence of the primary antibody in control specimens. All the figured specimens were deposited in the National Science Museum, Tokyo (NSM).
Additional information
Como citar este artigo: Tanaka, G. et al. Bastonetes e cones mineralizados sugerem visão de cores em um peixe fóssil de 300 milhões de anos. Nat. Comum. 5:5920 doi: 10.1038/ncomms6920 (2014).
Referências
Parker, AR Sobre a origem da óptica. Optar. Tecnologia Laser. 43 , 323-329 (2011).
Shu, D.-G. et ai. Vertebrados do Cambriano Inferior do sul da China. Nature 402 , 42-46 (1999).
Hou, X.-G. et ai. Novas evidências sobre a anatomia e filogenia dos primeiros vertebrados. Proc. R. Soc. Londres. B 269 , 1865-1869 (2002).
Shu, D.-G. et al. Head and backbone of the Early Cambrian vertebrate Haikouichthys. Nature 421, 526–529 (2003).
Hou, X.-G. et al. The Cambrian Fossils of Chengjiang, China: the Flowering of Early Animal Life Blackwell (2004).
Aldridge, R. J. et al. The anatomy of conodonts. Phil. Trans. R. Soc. Lond. B 340, 405–421 (1993).
Sansom, R. S., Gabbott, S. E. & Purnell, M. A. Non-random decay of chordate characters causes bias in fossil interpretation. Nature 463, 797–800 (2010).
Fröhlich, F., Mayrat, A., Riou, B. & Secretan, S. Structures rètiniennes phosphatisèes dans l’ oeil gèant de Dollocaris, un crustacè fossile. Ann. Palèontol. 78, 193–204 (1992).
Tanaka, G. et ai. Um olho de mosca dolicopodídeo do Eoceno excepcionalmente bem preservado: função e significado evolutivo. Proc. R. Soc. Londres. B 276 , 1015-1019 (2009).
Schoenemann, B. & Clarkson, ENK Descoberta de estruturas sensoriais de cerca de 400 milhões de anos nos olhos compostos de trilobites. Sci. Rep. 3 , 1429 (2013).
Schoenemann, B. et ai. O sofisticado sistema visual de um minúsculo crustáceo cambriano: análise de um olho composto fóssil perseguido. Proc. R. Soc. Londres. B 279 , 1335-1340 (2012).
Duncan, IJ & Briggs, DEG Insetos preservados tridimensionalmente. Nature 381 , 30-31 (1996).
Collin, S. P. et al. Ancient colour vision: multiple opsin genes in the ancestral vertebrates. Curr. Biol. 13, R864–R865 (2003).
Voplensky, P. & Kozmik, Z. Eye evolution: common use and independent recruitment of genetic components. Phil. Trans. R. Soc. Lond. B. 364, 2819–2832 (2009).
Vinther, J., Briggs, DEG, Prum, RO & Saranathan, V. A cor das penas fósseis. Biol. Lett. 4 , 522-525 (2008).
Vinther, J. et ai. Coloração estrutural em uma pena fóssil. Biol. Lett. 6 , 128-131 (2009).
Li, Q. et ai. Padrões de cores de plumagem de um dinossauro extinto. Ciência 327 , 1369-1372 (2010).
Li, Q. et ai. Reconstrução do Microraptor e a evolução da plumagem iridescente. Ciência 335 , 1215-1219 (2012).
Zhang, F. et al. Fossilized melanosomes and the colour of Cretaceous dinosaurs and birds. Nature 463, 1075–1078 (2010).
Barden, H. E. et al. Morphological and geochemical evidence of eumelanin preservation in the feathers of the Early Cretaceous bird, Gansus yumenensis. PLoS ONE 6, e25494 (2011).
Zidek, J. Kansas Hamilton quarry (Upper Pennsylvanian) Acanthodes, with remarks on the previously reported North American occurrences of the genus. Univ. Kansas Paleontol. Contributions 83, 1–41 (1976).
Cunningham, C. R. et al. The Upper Carboniferous Hamilton Fossil-Lagerstätte in Kansas: a valley-fill, tidally influenced deposit. Lethaia 26, 225–236 (1993).
Brazeau, M. The braincase and jaws of a Devonian ‘acanthodian’ and modern gnathostome origins. Nature 457, 305–308 (2009).
Pezzella, A. et al. An integrated approach to the structure of Sepia melanin: evidence for high proportion of degraded 5,6-dihydroxyindole-2-carboxylic acid units in the pigment blackbone. Tetrahedron 53, 8281–8286 (1997).
Ito, S. et al. Usefulness of alkaline hydrogen peroxide oxidation to analyze eumelanin and pheomelanin in various tissue samples: application to chemical analysis of human hair melanins. Pigment Cell Melanoma Res. 24, 605–613 (2011).
Ito, S. et al. Photoaging of human retinal pigment epithelium is accompanied by oxidative modifications of its eumelanin. Pigment Cell Melanoma Res. 26, 357–366 (2013).
Ito, S., Wakamatsu, K., Glass, K. & Simon, J. D. High-performance liquid chromatography estimation of cross-linking of dihydroxyindole moiety in eumelanin. Anal. Biochem. 434, 221–225 (2013).
Glass, K. et al. Direct chemical evidence for eumelanin pigment from the Jurassic period. Proc. Natl Acad. Sci. USA 109, 10218–10223 (2012).
Strauss, O. O epitélio pigmentar da retina na função visual. Fisiol. Rev. 85 , 845-881 (2005).
Nicol, JAC, Arnott, HJ & Best, ACG Tapeta lucida em peixes ósseos (Actinopterygii): um levantamento. Pode. J. Zool. 51 , 69-81 (1973).
Dearry, A., Edelman, JL, Miller, S. & Burnside, B. A dopamina induz movimentos retinomotores adaptativos à luz em cones de rã-touro via receptores D2 e no epitélio pigmentar da retina via receptores D1. J. Neurochem. 54 , 1367-1378 (1990).
Braekevelt, CR & Richardson, KC Retinal pigmento epitelial estrutura fina no galah australiano ( Eolophus roseicapillus ) (aves). Hist. Histopatol. 11 , 437-443 (1996).
Helfman, G. S., Collette, B. B., Facey, D. E. & Bowen, B. W. The Diversity of Fishes 2nd ednWiley-Blackwell (2009).
Davis, S. P., Finarelli, J. A. & Coates, M. I. Acanthodes and shark-like conditions in the last common ancestor of modern gnathostomes. Nature 486, 247–250 (2012).
Pilgrim, B. L. & Franz-Odendaal, T. A. A comparative study of the ocular skeleton of fossil and modern chondrichthyans. J. Anat. 214, 848–858 (2009).
Yokoyama, S. & Yokoyama, R. Adaptive evolution of photoreceptors and visual pigments in vertebrates. Annu. Rev. Ecol. Syst. 27, 543–567 (1996).
Iwata, H. & Ukai, Y. SHAPE: um pacote de programa de computador para avaliação quantitativa de formas biológicas baseado em descritores elípticos de Fourier. J. Hered. 93 , 384-385 (2002).
Kuhl, FP & Giardina, CR Elliptic Fourier características de um contorno fechado. Computar. Gráfico. Processo de Imagem. 18 , 236-258 (1982).
Ubukata, T. Restrições filogenéticas e modificação adaptativa no contorno da concha de Pectinidae (Bivalvia). Vênus 62 , 149-160 (2004).
Reconhecimentos
This work was supported by the Science Research of Education and Science Government of Japan (grant no. 24540501 to G.T. and no. 24340129 to H.M.).
Author information
Affiliations
Contribuições
Este projeto foi idealizado pela GT e a ARP concebeu a suíte de testes. Os dados fósseis foram analisados por todos os autores. ARP, DJS e GT compuseram o texto.
autor correspondente
Declarações de ética
Interesses competitivos
Os autores declaram não haver interesses financeiros concorrentes.
Informação suplementar
Figuras Suplementares
Figuras complementares 1-3 (PDF 853 kb)
Conjunto de dados suplementar 1
Dados de bastonetes e cones deste estudo e fontes da literatura, e três pontuações de componentes principais (PC1-3) com base na análise de contorno externo de bastonetes e cones usando Análise Elíptica de Fourier (EFA). (XLS 150kb)
Conjunto de dados suplementar 2
Informação de código de cadeia do esboço de 509 (haste/cone) espécime usado neste estudo. (XLSX 105kb)
Direitos e permissões
Sobre este artigo
Citar este artigo
Tanaka, G., Parker, A., Hasegawa, Y. et ai. Bastonetes e cones mineralizados sugerem visão de cores em um peixe fóssil de 300 milhões de anos. Nat Commun 5, 5920 (2014). https://doi.org/10.1038/ncomms6920

Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.