Molecular composition and ultrastructure of Jurassic paravian feathers
Scientific Reports volume 5, Article number: 13520 (2015)
Resumo
As penas estão entre as estruturas epidérmicas mais complexas conhecidas e têm uma trajetória evolutiva bem documentada em dinossauros não-aviários e aves basais. Além disso, microcorpos semelhantes a melanossomas preservados em associação com plumagem fóssil têm sido usados para reconstruir a cor, o comportamento e a fisiologia originais. No entanto, esses supostos melanossomos antigos podem alternativamente representar resíduos de microrganismos, uma interpretação conflitante composta pela falta de dados químicos inequívocos. Portanto, usamos imagens moleculares sensíveis, apoiadas por vários testes analíticos independentes, para demonstrar que os apêndices epidérmicos filamentosos em um novo espécime de Anchiornis compreendem eumelanossomos remanescentes e microestruturas semelhantes a fibrilas, preservadas como eumelanina endógena e fosfato de cálcio autigênico. Esses resultados fornecem novos insights sobre a evolução inicial das penas no nível subcelular e determinam inequivocamente que os melanossomos podem ser preservados em penas fósseis.
Introdução
The Middle-Late Jurassic fossil assemblage found in the Tiaojishan Formation of Liaoning Province in northeastern China has yielded unparalleled evidence on the early evolution of birds1,2,3,4. Most importantly, the identification of various feather-like integumental appendages in non-avian and stem avialan theropods has illuminated the diversity and distribution of plumage structures during their adaptive transition towards use in flight4. Epidermal traces in the Tiaojishan Formation are preserved as either faint impressions or phosphatised and carbonised residues4,5. The latter were long thought to be a product of keratin-degrading bacteria6. However, more recent interpretations have favoured fossilised melanosomes; that is, melanin-bearing cellular organelles responsible in part for the colouration of skin and its structural derivatives7. This landmark hypothesis has spawned an entirely new field of exploratory inference into dinosaurian colour5,7,8,9,10,11, behaviour5 and physiology12.
No entanto, também encontrou um debate vívido (ver ref. 13 para revisão). Isso se concentra na observação de que os micróbios que colonizam os tecidos epidérmicos durante a decomposição são praticamente indistinguíveis dos microcorpos semelhantes aos melanossomos reconhecidos em fósseis 14 , 15 . Tal crítica é agravada pela falta de traços moleculares inequívocos de pigmentos melânicos em penas antigas e apêndices semelhantes a penas 15 , 16 . De fato, as reivindicações de melanossomos encontrados na plumagem de dinossauros não-aviários e aviários-tronco basearam-se fundamentalmente na morfologia externa 5 , 7 , 8 , 9 , 10 , 11 , 12 , mas isso é comprovadamente inadequado para discriminar organelas de pigmento de bactérias penetrantes 15 . Além disso, dados químicos 17 , 18 , 19 , 20 mostraram-se inconclusivos ou carentes de especificidade 21 e supostos melanossomos ocorrendo como impressões ('melanossomas moúldicos' 9 ) implicam de forma problemática que o substrato circundante era mais resistente à degradação do que os próprios microcorpos 15 . Presume-se que a matriz que retém os 'melanossomas múldicos' seja queratina residual 9 or ‘remineralized melanin’5, yet no attempt has been made to test these hypotheses15. An alternative origin might therefore be plausible because melanosome-like impressions are occasionally found in clay minerals, together with silica crystals and other sedimentary grains adjacent to preserved integumentary structures15,20.
Here we address the unresolved problem of accurately identifying microbodies, imprints and fibrous structures associated with fossilised feather remains via high-resolution imaging and molecular analysis of an exceptionally preserved new specimen (YFGP-T5199, housed in Yizhou Fossil and Geology Park) of the paravian Anchiornis22. Our results show that multiple local taphonomic pathways incorporating both organic and geochemical agents contributed to the retention of fibrils, eumelanin pigment and eumelanosomes in the integumentary filaments of YFGP-T5199.
Results
Fossil specimen and rationale for sample selection
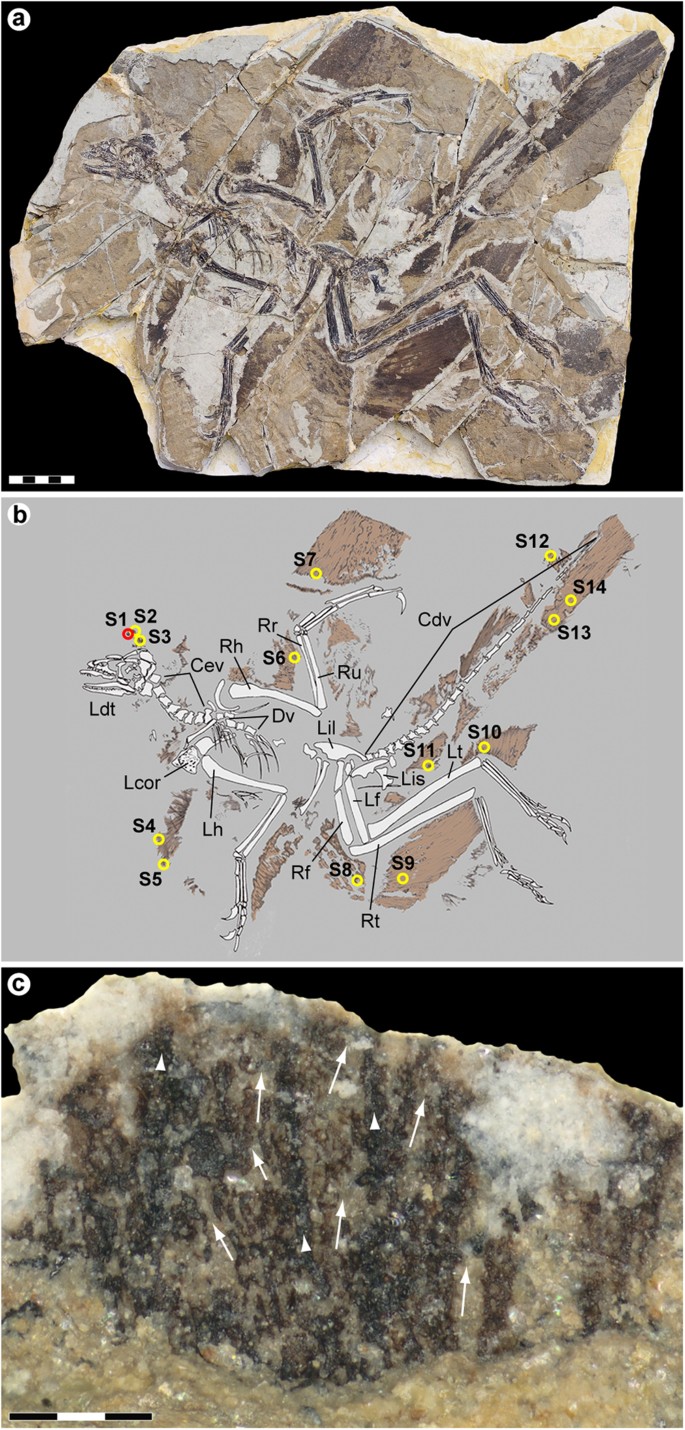
An extensively feathered Jurassic paravian referable to Anchiornis huxleyi was recovered from the Yaolugou locality in Jianchang County, western Liaoning (see the Supplementary Methods section online). Although initially classified as a non-avian troodontid theropod1, recent studies suggest that Anchiornis represents a stem avialan, more primitive than Archaeopteryx4,23. The fossil is diagenetically flattened but otherwise essentially complete, comprising an articulated skeleton with plumage remnants forming a dark corona around the bones (Fig. 1a,b). Some integument residues were lost during preparation (see the Supplementary Methods section online); however, patches of feathers and feather-like structures extend along the back half of the skull, lateral to the shoulder girdle, above the pelvic girdle and along the forelimbs, hind limbs and tail (Fig. 1a,b).
Anchiornis huxleyi espécime YFGP-T5199.
( a ) representação fotográfica e ( b ) representação diagramática. Os círculos numerados indicam a localização das amostras de plumagem usadas para análises moleculares e/ou de imagem. O círculo vermelho (S1) demarca a amostra 'frontal' usada como base para nossa investigação; os círculos amarelos (S2–S14) indicam amostras usadas para imagens SEM de suporte. Cdv, vértebras caudais; Cev, vértebras cervicais; Dv, vértebras dorsais; Lcor, coracóide esquerdo; Ldt, dentista esquerdo; Lf, fêmur esquerdo; Lh, úmero esquerdo; Lil, ílio esquerdo; Lis, ísquio esquerdo; Lt, tíbia esquerda; Rf, fêmur direito; Rh, úmero direito; Rr, raio direito; Rt, tíbia direita; Ru, ulna direita. Barra de escala: 5 cm. Fotografia de Pascal Godefroit e Ulysse Lefèvre. Desenho de Ulysse Lefèvre. ( c ) Detalhe de S1 após a preparação inicial mostrando fitas centrais mais escuras (pontas de seta) com arranjos difusos de filamentos ramificando-se lateralmente em ângulos agudos (setas). Observe que a área analisada ainda está coberta por matriz sedimentar (veja também a Fig. S1 Complementar ). Barra de escala: 300 μm. Fotografia de Johan Lindgren.
Fourteen samples (S1–S14) ranging in size from about 2 × 2 to 10 × 10 mm were removed from the plumage surfaces (Fig. 1b). One of these (S1) was selected for detailed morphological and molecular examination. S1 was collected some distance above the skull roof (Fig. 1b), in the region of the ‘forecrown’ sensu ref. 5 (note that the inferred dorsal crest in Anchiornis may be an artefact of preservation11,24). The sample was considered optimal for investigation because: (1) it showed greyish-brownish colouration indicative of organic remains; (2) was uncovered from a ‘fresh’ sub-surface layer within the sedimentary matrix; (3) produced part and counterpart sub-samples that revealed internal structuring of the filamentous epidermal appendages (Supplementary Fig. S1); and (4) similar ‘crest’ feathers from another Anchiornis fossil (see below) have been interpreted as housing pheomelanosomes5; that is, spheroid melanosomes dominated by pheomelanin pigment25.
Descrição das estruturas e microcorpos epidérmicos filamentosos
Os apêndices tegumentares em S1 assemelham-se superficialmente a penas de aves existentes. Eles compreendem uma fita central maior (e mais escura) ( Fig. 1c – pontas de seta) com arranjos filamentosos difusos ramificando-se lateralmente em ângulos agudos ( Fig. 1c – setas). Em seu estado atual, um tanto comprimido, os filamentos mais finos variam em largura de cerca de 20 a 30 μm, enquanto os filamentos maiores medem aproximadamente 40 a 50 μm de diâmetro.
Sob microscopia eletrônica de varredura (MEV), os filamentos individuais aparecem como folhas espessas e dobradas de matéria amorfa. Esta morfologia é consistente com a de penas degradadas experimentalmente 26 e sugere distorção por compressão diagenética e/ou temperaturas elevadas. No entanto, algumas regiões aparentemente retêm a estrutura original, incluindo camadas contínuas de fibrilas densamente empacotadas organizadas em macrofibrilas e/ou feixes de fibrilas com uma orientação predominantemente longitudinal ( Fig. 2 ). A maioria das fibrilas é mostrada em relevo, sugerindo que elas retêm pelo menos alguma da sua forma tridimensional original ( Fig. 2a ); entretanto, dobras, enrugamentos e ramificações extensos ( Fig. 2d — setas, e) são congruentes com a perda de tensão durante a decomposição 27 , 28 . A fratura desigual expôs o material fibroso nas vistas tangencial oblíqua ( Fig. 2a ) e transversal ( Fig. 2c,d ), revelando que faz parte de estruturas maiores (fibras ou bárbulas) com formato cilíndrico ( Fig. 2c ). Os elementos fibrosos variam em tamanho de cerca de 80 nm (fibrilas) a > 10 μm (fibras/bárbulas) de diâmetro. Essas dimensões são amplamente comparáveis às registradas para componentes queratinosos de penas de aves existentes 27 , 28 , 29 , apesar da extensão da mineralização diagenética (veja abaixo).
Ultrastructure of YFGP-T5199 ‘forecrown’ feathers.
( a ) micrografia FEG-SEM de estruturas semelhantes a fibrilas e microcorpos sólidos (lado esquerdo da imagem) e vazios densamente espaçados feitos na matriz sedimentar adjacente ('minerais de argila': lado direito da imagem). Observe que as estruturas fibrosas e os microcorpos estão aproximadamente alinhados paralelamente uns aos outros, enquanto as impressões são orientadas mais aleatoriamente (aquelas com um eixo longitudinal definido quase perpendicular à direção principal dos tecidos fibrosos são marcadas com setas). Observe também a forma altamente variável dos vazios (um com um contorno subcircular é marcado com uma ponta de seta). Barra de escala: 5 μm. ( b ) Ampliação de ( a ) mostrando microcorpos alinhados em forma de bastonete com terminais arredondados. Barra de escala: 500 nm. ( c ) Visão transversal oblíqua de fibrilas densamente compactadas demonstrando sua organização em uma estrutura cilíndrica maior, presumivelmente uma fibra ou bárbula. As setas apontam para o preenchimento sedimentar com impressões elípticas orientadas aleatoriamente. Barra de escala: 5 μm. ( d ) Seção transversal de microestruturas semelhantes a fibrilas empilhadas e um tanto irregulares com um interior sólido (pontas de seta). O hemi-círculo da ponta de flecha envolve parcialmente um feixe de fibrilas presumido. Observe os padrões de ramificação (setas), possivelmente indicando perda de tensão. Barra de escala: 3 μm. ( e ) Detalhe da área marcada em ( d ) mostrando uma microestrutura enrugada e parcialmente dobrada aproximadamente de dimensões semelhantes a uma macrofibrila. Barra de escala: 500 nm.
Secções ultrafinas visualizadas utilizando microscopia electrónica de transmissão (TEM) revelaram estruturas em camadas de micrómetros de espessura ( Fig. 3 ), superficialmente semelhantes a fibrilas de queratina seccionadas de penas existentes (ver ref. 15 , Fig. 1a ).
Micrografias TEM de penas 'frontecrown' YFGP-T5199.
( a ) Microestruturas em camadas que são superficialmente semelhantes em tamanho e organização às fibrilas de queratina de penas de aves existentes. A texturização interna corrugada e a ruptura parcial são artefatos do processo de corte TEM. SEM-EDX ( Fig. 4 ) e IR ( Fig. 8 análise Barra de escala: 5 μm. ( b ) Uma seção separada do mesmo chip alguns micrômetros mais profundos no substrato de penas fósseis. Barra de escala: 10 μm. ( c ) Ampliação de ( b ) mostrando detalhes dos resíduos de penas e argilominerais aderentes. Barra de escala: 2 μm.
Pilhas de microcorpos alongados são vistos localmente aderindo firmemente, parcialmente embutidos ou mesmo fundidos com o substrato fibroso ( Fig. 2a,b ). Estes são grosseiramente alinhados em paralelo um ao outro e sua orientação geral segue a dos tecidos fibrosos ( Fig. 2a,b ). Os elementos individuais são em forma de haste com terminais arredondados e substancialmente mais longos do que largos. A maioria dessas hastes são retas ou levemente dobradas ( Fig. 2b ); no entanto, outros são fortemente flexionados ( Fig. Suplementar S2d,e —seta ).
Within the matrix immediately adjacent to the fibrous tissues are densely spaced imprints infesting either a eumelanin/calcium phosphate residue (see discussion below and Supplementary Fig. S2c,d,f), clay minerals (Fig. 2a) or microcrystalline aggregates (Fig. 2c and Supplementary Fig. S2h). Some impressions correspond in shape and size to the rod-shaped microbodies (Supplementary Fig. S2d,f,g). Additionally, they show similar alignment (Supplementary Fig. S2d,f,g) and rod-like elements are even retained in a few imprints (Supplementary Fig. S2d,e—arrow). Other impressions are morphologically more diverse, ranging from ovoid to elongate and they are also more randomly oriented (sometimes with their long axis set almost perpendicular to that of the fibrous tissues; Fig. 2a—arrows and Supplementary Fig. S2h).
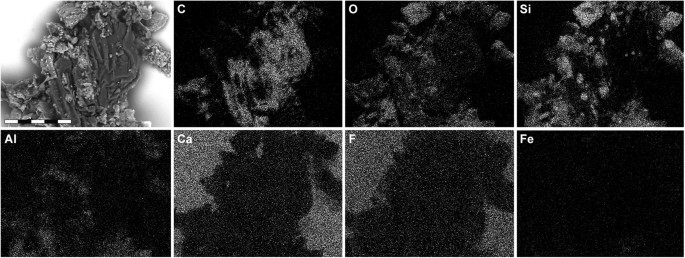
Single-element SEM-EDX maps of YFGP-T5199 ‘forecrown’ feathers.
White indicates high intensity whereas black indicates low intensity. Note relatively high levels of carbon (C) in the fossil feather material, whereas the sediment is dominated by silica (Si) and oxygen (O), with minor quantities of aluminium (Al) and only trace amounts of iron (Fe). Intensities from calcium (Ca) and fluoride (F) derive from the underlying spectrophotometric window (for IR microspectroscopic analysis). Scale bar: 50 μm.
Micrografias FEG-SEM e ToF-SIMS de penas 'frontecrown' YFGP-T5199.
( a ) micrografia FEG-SEM de material de penas e sedimentos circundantes. Imagens de close-up das áreas delimitadas são mostradas na Fig. S2 Suplementar . Barra de escala: 20 μm. ( b ) Mesma imagem que em ( a ). As linhas amarelas pontilhadas marcam as áreas (A1–A7) das quais os espectros nas Figs 6 e 7 e Figs Suplementares S5 e S7 foram coletados. ( c ) Uma imagem de íon negativo semitransparente mostrando a distribuição espacial de picos característicos de eumelanina (verde), fosfato (azul) e sílica (vermelho) sobrepostos à imagem FEG-SEM (veja também Fig. S4 Suplementar ). ( d ) Uma imagem de íon positivo semitransparente mostrando a distribuição espacial dos picos correspondentes a fosfato de cálcio (verde), potássio (azul) e alumínio + silício (vermelho) sobrepostos à imagem FEG-SEM (veja também Fig. S6 suplementar ) .
Em última análise, enquanto as semelhanças morfológicas e organizacionais das estruturas fibrosas e microcorpos para aqueles de queratina de penas degradadas e eumelanossomos remanescentes são impressionantes ( Fig. S3 suplementar ; veja também refs 27 , 28 , 30 , 31 ), a integração de dados químicos é necessária para discriminar entre resíduos endógenos e microrganismos exógenos que podem ocorrer associados a substratos queratináceos em decomposição (ver ref. 30 , fig. 6 ).
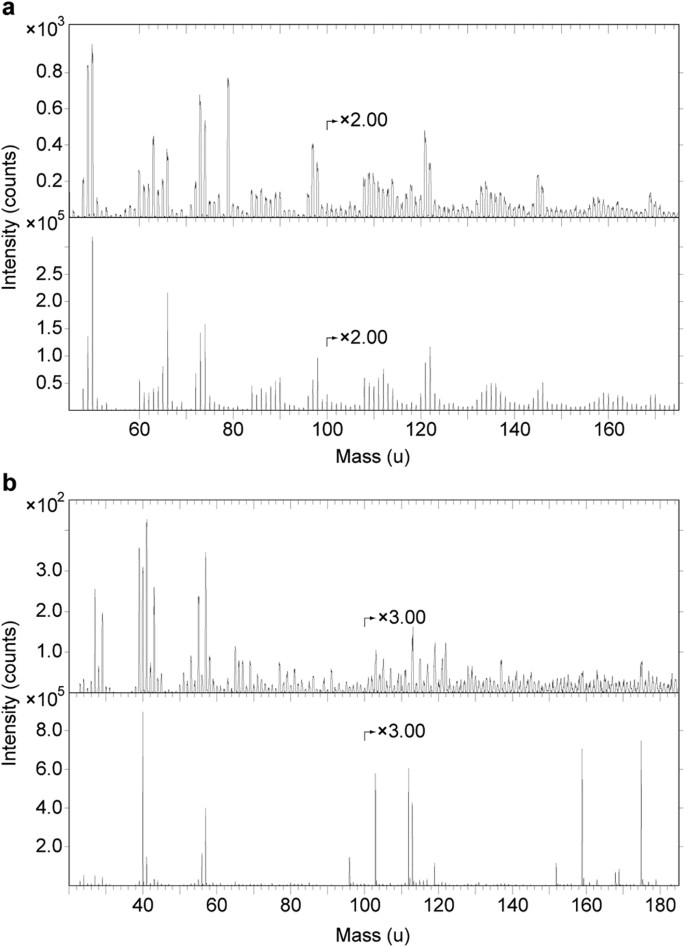
Espectros ToF-SIMS da área A1 juntamente com eumelanina e hidroxiapatita.
( a ) Espectro de íon negativo ToF-SIMS de A1 (topo) e eumelanina sintética (abaixo). Observe que todos os principais picos no espectro da eumelanina sintética também estão presentes no espectro fóssil e que ocorrem com aproximadamente a mesma distribuição de intensidade de sinal relativa (veja também Tabela Suplementar S1 ), indicando a presença de quantidades significativas de eumelanina na superfície do tecidos fibrosos. Picos adicionais no espectro fóssil originam-se de fosfato (PO 2 − e PO 3 − em 63 e 79 u, respectivamente) e íons relacionados ao silicato (SiO 2 − , SiO 3 − e SiO 3 H − em 60, 76 e 77 u , respectivamente). ( b ) Espectros de íons positivos ToF-SIMS de A1 (superior) e hidroxiapatita (inferior). Observe picos de fosfato de cálcio característicos em 103, 159 e 175 u no espectro fóssil, correspondendo a CaPO 2 + , Ca 2 PO 3 + e Ca 2 PO 4 + , respectivamente (consulte Tabela Suplementar S2 para atribuições de pico).
Análises elementares e moleculares
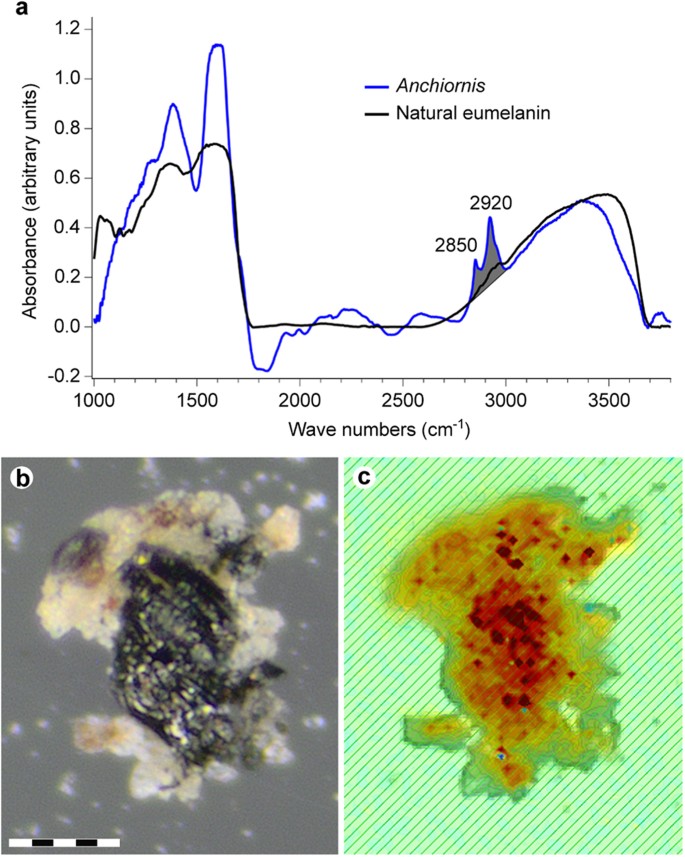
Energy-dispersive X-ray microanalysis (EDX) identified carbon as the primary component in the integumentary remains, which suggests an organic source (Fig. 4). In addition, time-of-flight secondary ion mass spectrometric (ToF-SIMS) imaging analysis detected negative ions characteristic of melanic pigments localised specifically to areas with fibrous tissues and embedded microbodies (e.g., A1–A3; Figs 5b,c and 6a and Supplementary Figs S2a–e, S4a,e, S5). Detailed comparisons with modern reference samples further revealed that all ‘characteristic’ peaks of the eumelanin molecular structure were present in the fossil spectra, with considerable agreement in both mass position and relative signal intensity distribution (Fig. 6a and Supplementary Table S1). In contrast, the surrounding sediment yielded mainly silica-related negative ions indicative of silicate-rich minerals (e.g., A4; Fig. 5b,c and Supplementary Figs S2a, S4b,e, S5). Phosphate-containing ions were also encountered over the entire surface, but at significantly higher intensities in the melanin-dominated areas (Fig. 5c and Supplementary Fig. S4d).
Espectros de modo de íons positivos gerados diretamente dos resíduos de penas mostraram aumento da intensidade de íons relacionados ao fosfato de cálcio, indicando localização preferencial deste mineral para os tecidos fibrosos e microcorpos (por exemplo, A1–A3; Figs 5b,d e 6b e Figs Suplementares S6a, e, S7 ). Íons relacionados a minerais, incluindo alumínio, silício, magnésio e potássio, foram encontrados na matriz adjacente (por exemplo, A4; Fig. 5b,d e Figs Suplementares S6b–e, S7 ); estes provavelmente denotam minerais de argila do grupo ilita 32 , como sugerido pela imagem TEM ( Fig. 3c ).
ToF-SIMS spectra from areas with microbody imprints (e.g., A5–A7; Fig. 5 and Supplementary Figs S2c,d,f–h, S4–S7) detected varied molecular compositions, ranging from melanin/calcium phosphate-dominated residues (A5) to silicate minerals (A6 and A7), incorporating regionalised intensities of calcium phosphate-related ions (A6).
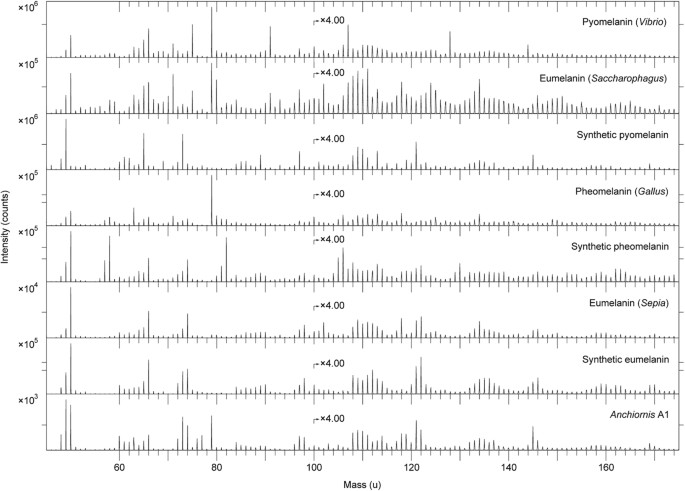
Comparative analyses were undertaken on synthetic and natural variants of eumelanin and pheomelanin, keratin, two peptidoglycans, five hopanoids, three porphyrins and three microbial mats33,34,35. We also examined a chemically derived pyomelanin, as well as pyomelanin from the bacterium Vibrio cholerae and eumelanin from the bacterium Saccharophagus degradans (Fig. 7). Based on these data, the fossil melanin from YFGP-T5199 displayed closest agreement with animal eumelanin (Fig. 7). Spectra acquired from the microbial melanins were also compatible in their ‘characteristic’ eumelanin peaks at 73, 74, 97, 98, 121, 122, 145 and 146 u; importantly though, these were significantly different in their relative abundances. The synthetic pyomelanin spectrum lacked all peaks corresponding to nitrogen-containing ions, including those indicative of eumelanin at 50, 66, 74, 98, 122 and 146 u.
ToF-SIMS spectra acquired from melanin reference samples and A1.
Negative ion ToF-SIMS spectra from various melanin standards and reference samples together with the spectrum from area A1. All spectra were acquired with the ToF-SIMS instrument optimised for high mass resolution. The prominent peak at 79 u (PO3−) in the spectra from pyomelanin (Vibrio), eumelanin (Saccharophagus) and pheomelanin (Gallus) derives from phosphate-containing contaminants, most likely originating from the melanin extraction and/or purification process.
Contribuições menores de orgânicos contendo enxofre foram identificadas nos espectros de YFGP-T5199, incluindo íons C n NS − em 58 (n = 1), 82 (n = 3) e 106 (n = 5) u e C n HS − íons em 57 (n = 2), 81 (n = 4) e 105 (n = 6) u. Estes picos foram igualmente proeminentes nas amostras de feomelanina sintética e natural ( Fig. 7 ) e mostraram co-localização significativa com picos 'típicos' relacionados com a eumelanina ( Fig. Suplementar S4a,c ). No entanto, os possíveis picos relacionados à feomelanina contendo enxofre eram visivelmente fracos nos espectros fósseis ( Figs 6a e 7 ), impedindo assim a determinação confiável de feomelanina ou incorporação diagenética de enxofre na estrutura molecular da eumelanina (como foi sugerido anteriormente para outros eumelaninas fósseis 33 , 35 ).
Não foram detectados peptidoglicanos ou hopanóides bacterianos e componentes proteináceos consistentes com queratinas também estavam ausentes. Por fim, não houve indícios de consolidantes e/ou conservantes que pudessem comprometer a integridade química da amostra.
Estes resultados foram corroborados por medições microespectroscópicas IR, que produziram absorbância localizada consistente com eumelanina natural, embora com contribuições menores da matriz sedimentar circundante ( Fig. 8 ).
IR absorbance data from YFGP-T5199 ‘forecrown’ feathers.
( a ) Espectro IR de ponto único registrado a partir da parte inferior do chip de amostra ilustrado em ( b , c ). A absorbância de banda larga ocorre nas regiões 900–1800 e 2500–3700 cm- 1 , consistente com a eumelanina natural. O espectro YFGP-T5199 foi registrado usando o modo de transmissão e uma abertura de 15 × 15 μm para reduzir as contribuições de sedimentos. A região de estiramento CH usada para a imagem de absorbância em ( c) está sombreada em cinza. ( b ) óptica e ( c ) imagem de absorbância de IR (sobreposta a uma imagem óptica), esta última registrada por um detector de matriz de plano focal (consulte a Métodos Suplementares on-line). A imagem IR é baseada na absorbância dos trechos CH na região de 2.820-3.000 cm- 1 de 2.760 espectros individuais (a absorbância aumenta de amarelo para vermelho). Os trechos CH estão associados a espectros semelhantes a eumelanina, que em conjunto com a falta de outros orgânicos no chip de amostra (como evidenciado por ToF-SIMS), sugerem derivação principalmente de resíduos de eumelanina. Observe que a distribuição espacial da absorbância de estiramento de CH segue intimamente o material enegrecido da pena (veja a consistência com a distribuição de carbono registrada por SEM-EDX; Fig. 4 ). Barra de escala: 50 μm.
Discussão
A organização microscópica dos restos epidérmicos em YFGP-T5199 se assemelha muito a fibrilas de queratina e eumelanossomos encontrados em penas de aves existentes, especialmente após a biodegradação seletiva da matriz polimérica amorfa 27 , 28 , 30 , 31 . A fidelidade morfológica excepcional desses apêndices filamentosos também revela uma hierarquia fibrilar que lembra a raque e o córtex da farpa 27 , o que pode ter conferido uma rigidez flexural às penas 'frontal' em YFGP-T5199. A arquitetura mecânica das penas paravianas pode, assim, ser mostrada para se estender além da macroanatomia grosseira 36 , 37 , para um nível subcelular de organização biológica.
Várias linhas de evidência independentes defendem uma origem eumelanossomática para os microcorpos em forma de bastonete nos tecidos epidérmicos: (1) a presença de eumelanina animal; (2) o tamanho, forma, distribuição e alinhamento paralelo, que ao contrário das células bacterianas não formam cadeias em série indicativas de fissão microbiana (ver ref. 15 , figs 1e e 2a , S1c2 e ref. 30 , fig. 6 ); e (3) a incorporação em estruturas semelhantes a fibrilas semelhantes à queratina de penas. No entanto, apesar desta notável semelhança morfológica, não conseguimos detectar quaisquer componentes proteináceos indicativos de queratinas. Em vez disso, os tecidos fibrosos consistiam em eumelanina e fosfato de cálcio, este último possivelmente derivado da reposição mineral. De fato, o vazamento de melanina pós-enterro pode ter fornecido um mecanismo para estabilização do tecido epidérmico ou replicação em YFGP-T5199 que foi facilitado ainda mais pelo rápido crescimento de minerais autigênicos 38 , 39 , 40 . A mineralização precoce é uma forma comum de preservação de tecidos moles lábeis 38 , 39 , 40 e muitas vezes envolve fosfato de cálcio em estruturas melânicas e/ou queratinizadas fossilizadas, incluindo sacos de tinta 41 , 42 , penas 5 , 43 e material de bainha de garra 44 .
Acredita-se que a associação de biomoléculas com um substrato mineral aumente o potencial de preservação de compostos orgânicos, seja por meio da inibição adsortiva da autólise em enzimas indutoras de decomposição, ou pela fixação de íons minerais em complexos organometálicos estáveis que impedem a quebra molecular 44 , 45 . polímero-fosfato de cálcio 39 , 40 , 44 e/ou polímero-argila 38 , 45 , 46 , 47 poderiam assim ser responsáveis pela retenção de moléculas de eumelanina em YFGP-T5199. Independentemente disso, a própria eumelanina é resistente ao apodrecimento 48 devido à sua composição polimérica extremamente densa e insolúvel, antimicrobiana e quimicamente robusta 49 , 50 , mesmo em comparação com a queratina 9 . Além disso, melanossomas maduros são essencialmente agregações sólidas de melanina, que é polimerizada em um andaime de fibrila amilóide insolúvel 51 , 52 , conferindo assim uma estabilidade arquitetônica que provavelmente permite que essas organelas especializadas persistam no registro fóssil.
Algumas impressões observadas na matriz que margeiam as microestruturas fibrosas (por exemplo, A5) são razoavelmente interpretadas como moldes externos de organelas de pigmento com base em sua compatibilidade dimensional, distributiva e química com os microcorpos semelhantes a bastonetes interpretados aqui como eumelanossomos remanescentes ( Fig. 5 e Suplementar Fig. S2d–f ) e pode ter sido derivada através da preparação ou ruptura da amostra – por exemplo, impressão de microcorpos localizados na contraparte (um cenário experimentalmente demonstrado para produzir impressões de melanossoma na matriz de queratina de penas modernas 8 ).
Uma origem de melanossoma também é plausivelmente inferida para outras estruturas múldicas em YFGP-T5199, incluindo aquelas expostas em A6 (observe o alinhamento contínuo das impressões em A5 e A6; Fig. 5b ). No entanto, a composição molecular nesta região corresponde amplamente à da rocha hospedeira (embora com uma quantidade aumentada de fosfato de cálcio), indicando a formação de moldes principalmente por argilas de aluminossilicato. Portanto, é possível que a nucleação e precipitação local e rápida de minerais de argila tenham ocorrido em sincronia com a decomposição do material queratinoso da pena, encapsulando estruturas orgânicas mais estáveis (como os eumelanossomos) dentro de nanotecidos de argila. Em um estágio posterior, as organelas sepultadas também decaíram, deixando espaços vazios ocos que por razões desconhecidas permaneceram vazios (assumindo que esses 'pseudomorfos' melanossomos não são negativos de relevos positivos na laje homóloga).
A afinidade de outras impressões é mais enigmática, incluindo aquelas em A7 ( Fig. Suplementar S2h ). Esses vazios não são apenas morfologicamente mais diversos, mas também são altamente desorganizados em comparação com os eumelanossomos sólidos ( Fig. 2a e Fig. Suplementar S2h ). Espacialmente, essas impressões também são aparentemente restritas a argilas de aluminossilicato e agregados de argila microcristalina ao longo do plano de estratificação ( Fig. 2a e Fig. Suplementar S2h ). Não conseguimos localizar quaisquer microestruturas tridimensionais correspondentes às impressões, o que implica que os fabricantes desses moldes eram menos resistentes à decomposição do que os eumelanossomos.
Nas penas modernas, os melanossomos podem ser organizados em camadas discretas onde as organelas individuais são consistentemente alinhadas ou orientadas mais erraticamente com apenas uniformidade local nas direções 8 , 53 . Assim, as impressões fósseis podem compreender moldes de melanossomos que apresentam maior variabilidade na forma e originados do córtex externo (que pode apresentar menos alinhamento dos melanossomos 8 ). Essas organelas também podem ser mais propensas à degradação devido à maior exposição. Alternativamente, vieses de preservação e diagênese poderiam potencialmente modificar a aparência de estruturas fósseis 46 , 54 , embora isso exigiria que as organelas de pigmento fossem transformadas não apenas em tamanho (como foi demonstrado anteriormente 26 ), mas também em forma e orientação durante a fossilização processo (assumindo que eles foram originalmente alinhados em paralelo aproximado com o plano de estratificação).
Por outro lado, colônias de micro-organismos degradadores de queratina geralmente formam um consórcio de táxons, resultando em uma mistura de formas e tamanhos 30 . Eles também estão inerentemente associados com penas em decomposição e podem formar padrões de agrupamento onde as células vizinhas são orientadas em direções comuns (ver ref. 30 , Fig. 6 ). Além disso, como é necessário algum decaimento para iniciar a mineralização 39 e porque a precipitação de fosfato de cálcio pode ser induzida microbianamente 40 , 55 , um mediador microbiano poderia ser racionalmente invocado na substituição parcial do material da pena. Isto, juntamente com a evidência morfológica de micróbios fossilizados 56 , tem implicações para a interpretação das impressões mais enigmáticas observadas na matriz que faz fronteira com as microestruturas fibrosas em YFGP-T5199 ( Fig. 2a e Fig. S2h Suplementar ). Dado o extenso registro fóssil de microrganismos 56 , 57 e que alguns desses vazios não estavam associados a uma assinatura molecular de eumelanina animal (por exemplo, A7), uma origem microbiana para essas impressões particulares não pode ser excluída. Assim, defendemos cautela contra a interpretação de todos os microcorpos e impressões fossilizadas como melanossomos e a reconstrução de cores de plumagem com base apenas na morfologia.
Um aspecto interessante dos melanossomas fossilizados em YFGP-T5199 é a sua forma exclusivamente alongada ( Fig. 2b e Fig. Suplementar S2e ). Isso se desvia marcadamente dos microcorpos relativamente atarracados relatados nas penas da 'coroa dianteira' de outro espécime referido de A . huxleyi (BMNHC PH828, alojado no Museu de História Natural de Pequim) 5 . Com algumas exceções possíveis ( Fig. 2a — ponta de seta), também não detectamos estruturas semelhantes a feomelanossomas (ver ref. 5 ). Várias explicações podem explicar essas discrepâncias, incluindo ontogenia, variabilidade intraespecífica e dimorfismo sexual, bem como tafonomia e/ou amostragem (ou seja, diferentes regiões dentro de uma crista multicolorida). Também temos que considerar a possibilidade de que: (1) YFGP-T5199 e BMNHC PH828 representem taxa diferentes; (2) melanossomos tegumentares se misturam com melanossomos de outras partes do corpo em um dos dois espécimes; e (3) os microcorpos e impressões relatados por Li et al. 5 e nós somos estruturas completamente diferentes.
De fato, BMNHC PH828 é consideravelmente menor (~60% pelo comprimento da ulna e tibiotarso) do que YFGP-T5199 e, portanto, pode representar um estágio ontogenético anterior de A . huxleyi . Além disso, YFGP-T5199 possui um processo dorsodistal do ísquio singularmente curto (consulte a Métodos Suplementares on-line), o que sugere a possibilidade de diferenças intraespecíficas e/ou sexuais que também podem ser refletidas no padrão de cor expresso. No entanto, o encaminhamento de BMNHC PH828 para A . huxleyi é problemático e não podemos excluir que este espécime represente um táxon paraviano intimamente relacionado, mas diferente (consulte a Métodos Suplementares on-line).
Além disso, embora tenha sido demonstrado que o aumento da temperatura e da pressão pode reduzir o tamanho dos melanossomos 26 , tais alterações podem não incluir também a forma (mas também ver ref. 10 ). A tafonomia, portanto, presumivelmente não pode explicar as diferentes microestruturas vistas em YFGP-T5199 e BMNHC PH828. Embora os melanossomas possam potencialmente se dispersar durante a decomposição 58 , os microcorpos em S1 estão localizados profundamente dentro de uma matriz fibrosa interpretada como queratina fossilizada. Concluímos, assim, que os melanossomos derivam de forma mais viável das penas 'frontal' de YFGP-T5199 em oposição a outros tecidos dérmicos e/ou órgãos internos (mas se isso também é verdade para BMNHC PH828 ainda não foi determinado).
Embora uma re-investigação da afinidade e preservação de BMNHC PH828 esteja além do escopo deste estudo, notamos que as impressões de 'feomelanossomas' relatadas por Li et al. (ref. 5 , Fig. S5 ) são preservados em grãos sedimentares em vez de traços de penas reconhecíveis, semelhantes às nossas impressões mais enigmáticas. Assim, essas impressões também podem representar melanossomas remobilizados ou microestruturas não melanossomas.
Nossa abordagem química estrutural e direta integrada fornece evidências convincentes de que os eumelanossomos e o pigmento eumelanina endógeno são preservados nos restos de penas de YFGP-T5199. Esse resultado se soma a uma crescente crônica da detecção molecular de eumelanina em fósseis 33 , 35 , 42 , 59 , 60 e demonstra a aptidão de técnicas experimentais rigorosas para identificar biomoléculas antigas e seu uso na caracterização de 'paleo-cores'.
Métodos
Quatorze amostras de penas (denominadas S1–S14) foram removidas do YFGP-T5199 usando um bisturi estéril ou uma serra manual. Uma amostra (S1) selecionada para análise molecular foi lavada três vezes sucessivamente em acetona, etanol 96% e água Milli-Q para remover contaminantes potenciais do manuseio humano. A amostra foi então seca sob um capuz, embrulhada frouxamente em papel alumínio fresco e armazenada isoladamente dentro de um recipiente de vidro estéril selado. O material de penas 'frescas' foi exposto antes da análise removendo o sedimento com um bisturi estéril; o chip de amostra resultante foi subsequentemente dividido em peças de peça e contraparte. Folha de alumínio fresca foi usada para cobrir todas as áreas de trabalho e luvas cirúrgicas estéreis foram usadas durante todo o manuseio e preparo. Nosso procedimento de tratamento foi idêntico para todas as amostras de referência modernas. Todos os experimentos foram repetidos para validar os resultados.
SEM and FEG-SEM
A triagem inicial de S1 foi realizada usando um SEM Hitachi S-3400N na amostra não revestida sob baixo vácuo e a composição elementar foi determinada por meio de mapeamento elementar usando análise EDX (tempo de varredura de 1900 segundos a 15 keV, 62,0 μA e uma distância de trabalho de 10 mm ). Após a análise ToF-SIMS, S1 foi revestido com uma mistura de ouro/paládio e reexaminado usando um Zeiss Supra 40VP FEG-SEM (2 keV, distância de trabalho 3-5 mm, detector de elétrons secundários Everhart-Thornley). As amostras S2–S14 foram revestidas com ouro ou ouro/paládio e analisadas usando um SEM ambiental QUANTA 200 (FEI) e um Zeiss Supra 40VP FEG-SEM.
TEM
O material de penas fósseis foi removido de S1 usando um bisturi estéril e colocado em álcool puro. O álcool foi então substituído por acetona e substituído gradualmente por resina epóxi (kit AGAR 100 Resin, R1031) para infiltrar totalmente os tecidos remanescentes. O epóxi foi deixado para polimerizar a 60°C por 48 h. Subamostras infiltradas foram cortadas com uma lâmina de barbear e, em seguida, seções de 1,5 μm de espessura foram cortadas usando uma faca de vidro montada em um ultrótomo (Leica Ultracut UCT). Uma faca de diamante foi empregada para o corte ultrafino a 50 nm, após o qual os cortes foram fixados em grades de cobre revestidas com piolofórmio. Estes foram inseridos em um microscópio eletrônico de transmissão JEOL JEM-1230 executado a 80 kV. As áreas de interesse foram fotografadas usando uma câmera Gatan MultiScan 794 CCD.
ToF-SIMS
The ‘freshly’ prepared part and counterpart sub-samples of S1 were fixed on a metal block using double-sided tape (Supplementary Fig. S1) and then immediately inserted into a ToF-SIMS IV instrument (IONTOF GmbH). ToF-SIMS analyses in the static SIMS mode were performed using 25 keV Bi3+ primary ions and low energy electron flooding for charge compensation. High mass resolution data were acquired in the bunched mode (m/∆m ~ 5000) at a spatial resolution of ~3–4 μm, whereas high image resolution data were obtained without bunching (m/∆m ~ 300, spatial resolution ~0.2–0.5 μm); in both cases at 256 × 256 pixels. The coordinates for all positions investigated were monitored in order to allow for subsequent FEG-SEM analysis of the same areas.
IR microspectroscopy
Tecidos fósseis e sedimentos foram removidos de S1 usando um bisturi estéril, suspensos em água Milli-Q e depois colocados em janelas de infravermelho CaF 2 e deixados para secar ao ar sob um capuz à temperatura ambiente. CaF 2 janelas de infravermelho As medições microespectroscópicas infravermelhas foram registradas em duas linhas de luz: SMIS na instalação de radiação síncrotron SOLEIL, França e D7, laboratório MAX-IV, Suécia. Na SOLEIL, a fonte de fótons infravermelhos foi acoplada a um espectrômetro Thermo Fisher Nicolet Nexus 5700 FTIR equipado com um microscópio Continuum XL. Um detector MCT-A de ponto único e uma abertura de 15 × 15 μm foram usados para as medições. No laboratório MAX-IV, a montagem combinou um microscópio Hyperion 3000 com um espectrômetro FTIR Bruker IFS66/v. Os espectros de imagem foram registrados no modo off-line usando um detector de matriz de plano focal MCT consistindo em 128 × 128 elementos detectores individuais. Ambos os microscópios operaram no modo de transmissão a 4 cm -1 resolução.
Informações adicionais
Como citar este artigo : Lindgren, J. et al. Composição molecular e ultraestrutura de penas paravianas jurássicas. Sci. Rep. 5 , 13520; doi: 10.1038/srep13520 (2015).
References
Hu, D., Hou, L., Zhang, L. & Xu, X. A pre-Archaeopteryx troodontid theropod from China with long feathers on the metatarsus. Nature. 461, 640–643 (2009).
Xu, X., You, H., Du, K. & Han, F. An Archaeopteryx-like theropod from China and the origin of Avialae. Nature. 475, 465–470 (2011).
Godefroit, P. et al. Reduced plumage and flight ability of a new Jurassic paravian theropod from China. Nat Commun. 4, 1394 (2013).
Godefroit, P. et al. A Jurassic avialan dinosaur from China resolves the early phylogenetic history of birds. Nature. 498, 359–362 (2013).
Li, Q. et al. Plumage color patterns of an extinct dinosaur. Science. 327, 1369–1372 (2010).
Davis, PG & Briggs, DEG Fossilização de penas. Geologia. 23, 783-786 (1995).
Vinther, J., Briggs, DEG, Prum, RO & Saranathan, V. A cor das penas fósseis. Biol Lett. 4, 522-525 (2008).
Vinther, J., Briggs, DEG, Clarke, J., Mayr, G. & Prum, RO Coloração estrutural em uma pena fóssil. Biol Lett. 6, 128-131 (2010).
Zhang, F. et ai. Melanossomos fossilizados e a cor dos dinossauros e pássaros do Cretáceo. Natureza. 463, 1075-1078 (2010).
Carney, RM, Vinther, J., Shawkey, MD, D'Alba, L. & Ackermann, J. Novas evidências sobre a cor e a natureza da Archaeopteryx pena Nat Comun. 3.637 (2012).
Li, Q. et ai. Reconstrução do Microraptor e a evolução da plumagem iridescente. Ciência. 335, 1215-1219 (2012).
Li, Q. et ai. A evolução do melanossoma indica uma mudança fisiológica chave nos dinossauros emplumados. Natureza. 507, 350-353 (2014).
Edwards, NP, Manning, PL & Wogelius, RA Pigmentos ao longo do tempo. Pigment Cell & Melanoma Res. 27, 684-685 (2014).
Schweitzer, MH Preservação de tecidos moles em vertebrados terrestres do Mesozóico. Annu Rev Earth Planet Sci. 39, 187-216 (2011).
Moyer, AE et ai. Melanossomos ou micróbios: testando uma hipótese alternativa para a origem de microcorpos em penas fósseis. Sci Rep. 4, 4233 (2014).
McNamara, ME A tafonomia da cor em insetos fósseis e penas. Paleontologia. 56, 557-575 (2013).
Barden, HE et ai. Evidências morfológicas e geoquímicas da preservação da eumelanina nas penas da ave do Cretáceo Inferior, Gansus yumenensis . PLoS UM. 6, e25494 (2011).
Wogelius, RA et ai. Metais traço como biomarcadores para pigmento eumelanina no registro fóssil. Ciência. 333, 1622-1626 (2011).
Manning, PL et al. Imagens químicas baseadas em síncrotron revelam padrões de plumagem em um pássaro precoce de 150 milhões de anos. J Anal At Spectrom. 28, 1024-1030 (2013).
Egerton, VM et ai. O mapeamento e diferenciação de assinaturas elementares biológicas e ambientais nos restos fósseis de uma ave de 50 milhões de anos. J Anal At Spectrom. 30, 627-634 (2015).
Vinther, J. Um guia para o campo da cor paleo: a melanina e outros pigmentos podem fossilizar: a reconstrução de padrões de cores de organismos antigos pode fornecer novos insights para a ecologia e o comportamento. Bioensaios. 37, 643-656 (2015).
Xu, X. et ai. Um novo fóssil de dinossauro maniraptoran emplumado que preenche uma lacuna morfológica na origem aviária. Chin Sci Bull. 54, 430-435 (2009).
Foth, C., Tischlinger, H. & Rauhut, OWM Novo espécime de Archaeopteryx fornece insights sobre a evolução das penas pennaceous. Natureza. 511, 79-82 (2014).
Foth, C. On the identification of feather structures in stem-line representatives of birds: evidence from fossils and actuopalaeontology. Paläontol Z. 86, 91–102 (2012).
Liu, Y. et al. Comparisons of the structural and chemical properties of black and red human hair melanosomes. Photochem Photobiol. 81, 135–144 (2005).
McNamara, M. E., Briggs, D. E. G., Orr, P. J., Field, D. J. & Wang, Z. Experimental maturation of feathers: implications for reconstructions of fossil feather colour. Biol Lett. 9, 20130184 (2013).
Lingham-Soliar, T., Bonser, R. H. C. & Wesley-Smith, J. Selective biodegradation of keratin matrix in feather rachis reveals classic bioengineering. Proc R Soc B. 277, 1161–1168 (2010).
Lingham-Soliar, T. & Murugan, N. A new helical crossed-fibre structure of ß-keratin in flight feathers and its biomechanical implications. PLoS ONE. 8, e65849 (2013).
Martínez-Hernández, A. L., Velasco-Santos, C., de Icaza, M. & Castaño, V. M. Microstructural characterisation of keratin fibres from chicken feathers. Int J Environ Poll. 23, 162–178 (2005).
Ichida, J. M. et al. Bacterial inoculum enhances keratin degradation and biofilm formation in poultry compost. J Microbiol Meth. 47, 199–208 (2001).
Rodziewicz, A. & Łaba, W. Biodegradação de queratina de penas por Bacillus cereus em cultura pura e composto. EJPAU. 11, 03 (2008).
Meunier, A. Clays (Springer-Verlag, 1986).
Lindgren, J. et ai. Preservação molecular do pigmento melanina em melanossomas fósseis. Nat Comun. 3, 824 (2012).
Leefmann, T. et ai. Caracterização espectral de dez lipídios cíclicos usando espectrometria de massa de íons secundários de tempo de voo. Espectro de Massa Rapid Commun. 27, 565-581 (2013).
Lindgren, J. et al. Skin pigmentation provides evidence of convergent melanism in extinct marine reptiles. Nature. 506, 484–488 (2014).
Xu, X., Zhou, Z.-H. & Prum, R. O. Branched integumental structures in Sinornithosaurus and the origin of feathers. Nature. 410, 200–204 (2001).
Xu, X., Zheng, X. & You, H. A new feather type in a nonavian theropod and the early evolution of feathers. Proc Natl Acad Sci. 106, 832–834 (2009).
Gabbott, S. E., Norry, M. J., Aldridge, R. J. & Theron, J. N. Preservation of fossils in clay minerals; a unique example from the Upper Ordovician Soom Shale, South Africa. Proc Yorkshire Geol Soc. 53, 237–244 (2001).
Briggs, D. E. G. The role of decay and mineralization in the preservation of soft-bodied fossils. Annu Rev Earth Planet Sci. 31, 275–301 (2003).
Briggs, D. E. G. & Wilby, P. R. The role of the calcium carbonate-calcium phosphate switch in the mineralization of soft-bodied fossils. J Geol Soc London. 153, 665–668 (1996).
Kear, AJ, Briggs, DEG & Donovan, DT Decay e fossilização de tecido não mineralizado em cefalópodes coleóides. Paleontologia. 38, 105-131 (1995).
Glass, K. et ai. Impacto da diagênese e maturação na sobrevivência da eumelanina no registro fóssil. Org Geochem. 64, 29-37 (2013).
Bergmann, U. et ai. Archaeopteryx e química óssea totalmente reveladas por meio de imagens síncrotron. Proc Natl Acad Sci. 107, 9060-9065 (2010).
Schweitzer, MH et ai. da queratina na ave do Cretáceo Superior Rahonavis ostromi . J Vert Paleontol. 19, 712-722 (1999).
Yu, B. et al. The role of clay minerals in the preservation of organic matter in sediments of Qinghai Lake, NW China. Clays Clay Min. 57, 213–226 (2009).
Pan, Y., Sha, J. & Fürsich, F. T. A model for organic fossilization of the Early Cretaceous Jehol Lagerstätte based on the taphonomy of “Ephemeropsis trisetalis”. Palaios. 29, 363–377 (2014).
Edwards, N. P. et al. Infrared mapping resolves soft tissue preservation in 50 million year-old reptile skin. Proc R Soc B. 278, 3209–3218 (2011).
Hollingworth, N. T. J. & Barker, M. J. in The Processes of Fossilization (ed. Donovan, S. K. ) 105–119 (Belhaven Press, 1991).
Sulaimon, S. S. & Kitchell, B. E. The biology of melanocytes. Vet Derm. 14, 57–65 (2003).
McGraw, K. J. in Bird Coloration Vol. 1 (eds Hill, G. E. & McGraw, K. J. ) 243–294 (Harvard Univ. Press, 2006).
Watt, B., Raposo, G. & Marks, M. S. in Functional Amyloid Aggregation (eds Rigacci, S. & Bucciantini, M. ) 89–113 (Research Signpost, 2010).
Delevoye, C., Giordano, F., Marks, M. S. & Raposo, G. in Melanins and Melanosomes: Biosynthesis, Biogenesis, Physiological and Pathological Functions (eds Borovanský, J. & Riley, P. A. ) 247–294 (Wiley-VCH Verlag GmbH & Co. KGaA, 2011).
Shawkey, M. D., D’Alba, L., Xiao, M., Schutte, M. & Buchholz, R. Ontogeny of an iridescent nanostructure composed of hollow melanosomes. J Morph. 276, 378–384 (2015).
Orange, F., Lalonde, S. V. & Konhauser, K. O. The formation and preservation of Synechococcus elongatus cell molds in simulated silica sinter: implications for the identification of microfossils. Geomicrobiol J. 30, 327–336 (2013).
Hirschler, A., Lucas, J. & Hubert, J.-C. Bacterial involvement in apatite genesis. FEMS Microbiol Ecol. 73, 211–220 (1990).
Westall, F. The nature of fossil bacteria: a guide to the search for extraterrestrial life. J Geophys Res. 104, 16,437–16,451 (1999).
Pacton, M., Fiet, N. & Gorin, G. Revisitando a matéria orgânica amorfa em laminitos Kimmeridgian: qual é o papel do processo de vulcanização na amorfização da matéria orgânica? Terra Nova. 18, 380-387 (2006).
McNamara, ME, Kaye, JS, Benton, MJ & Orr, PJ Melanossomas não tegumentares podem influenciar reconstruções das cores da pele de vertebrados fósseis. Paper apresentado no 4º Congresso Internacional de Paleontologia . A história da vida: uma visão do Hemisfério Sul , Mendoza, Argentina. Volume de resumo: Ianigla, CCT-Conicet (2014, 28 de setembro a 3 de outubro).
Glass, K. et ai. Evidência química direta do pigmento eumelanina do período Jurássico. Proc Natl Acad Sci. 109, 10218-10223 (2012).
Tanaka, G. et ai. Bastonetes e cones mineralizados sugerem visão de cores em um peixe fóssil de 300 milhões de anos. Nat Comun. 5, 5920 (2014).
Reconhecimentos
C. Rasmussen ajudou durante o trabalho de laboratório. SN Wai forneceu uma colônia de Vibrio cholerae SNW28 e L. Hederstedt cultivou a bactéria. L. Carlred auxiliou na purificação dos padrões naturais de melanina. O tempo de feixe foi alocado no SMIS, instalação de radiação síncrotron SOLEIL, França (proposta 20131382) e D7, laboratório MAX-IV, Suécia. P. Dumas auxiliou durante as medições de IR no SOLEIL. Esta pesquisa foi apoiada por doações do Conselho de Pesquisa Sueco (JL), Fundação Crafoord (JL e PU) e National Geographic Society (RMC).



Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.