“Last Universal Common Ancestor” (LUCA) – CONDIÇÕES PARA A ORIGEM DA VIDA EM FONTES HIDROTERMAIS ALCALINAS.
A sopa primordial de Haldane
permanece como a hipótese central na origem da vida. Entretanto, sua
sopa é homogênea em pH e tem um potencial de oxi-redução (redox), e por
isso não tem capacidade de produção de energia via quimiosmose. Tal
processo de produção de energia é estritamente necessário para o
metabolismo do carbono e produção de energia em todos os organismos
quimiotrófos de vida-livre. Considerando que gradientes de prótons
formam-se naturalmente em aberturas hidrotermais alcalinas, são vistos
como centrais para a origem da vida. Isto porque as primeiras células
poderiam ter aproveitado uma força geomagnética para se originar e fazer
a transição necessária para se distanciar de fontes hidrotermais,
seguindo o processo evolutivo.

Fonte Hidrotermal alcalina Lost City
Na década de 1920, Aleksandr Oparin e
John B. S. Haldane produziram trabalhos científicos paralelamente onde
cogitaram juntos uma hipótese sobre o surgimento da vida na Terra.
Concordavam que esse fenômeno teria ocorrido a partir de moléculas
orgânicas presentes na atmosfera primitiva, percoladas no oceano,
combinando-se a substâncias inorgânicas.
Para ambos, a Terra primitiva passou por
intensos processos vulcânicos, emitindo na atmosfera grandes quantidades
de moléculas (metano – CH4, amônia – NH3, gás hidrogênio – H2 e água H2O)
que permaneciam suspensos. Por ação da força gravitacional, e o aumento
contínuo da concentração de destas moléculas através de erupções
vulcânicas e ação da chuva, as moléculas orgânicas eram então
direcionadas aos mares, e com o passar do tempo, transformaram-se em uma
imensa “sopa nutritiva”, rica em compostos orgânicos, eventualmente
formando os coacervados (junção de moléculas circundadas por água).
Haldane sugeriu que a radiação
ultra-violeta (UV) fornecia toda energia necessária para converter
metano, amônia e água nos primeiros compostos orgânicos nos oceanos da
Terra primitiva (Lane et al, 2010).
Para Haldane, a produção de moléculas
maiores levou a origem de macromoléculas, partículas virais e,
finalmente, culminou nas primeiras células totalmente desenvolvidas.
Haldane supôs que os primeiros seres vivos eram fermentadores
heterotróficos que consumiram a sopa orgânica remanescente, retendo a
evolução biológica até a origem da fotossíntese, em que a vida se
desenrolou até as formas atuais.
Grande parte da tese de Haldane foi
suportada por Stanley Miller (1953) com a síntese inorgânica de
moléculas orgânicas no laboratório.
No geral, a descrição de Haldane estava
basicamente correta. A definição de sopa orgânica é hoje em dia
estreitamente linkada à ideia de que a origem da vida e a origem da
replicação são o mesmo fenômeno. A seleção natural continua a ser o
maior mecanismo conhecido no qual formas mais complexas podem evoluir, e
a seleção natural requer um replicador.
Não existe alternativa viável à ideia do
“RNA-World”, ou seja, certamente houve um tempo antes das proteínas e do
DNA, quando o RNA era a base molecular tanto da catálise como da
replicação. Alguns elementos do conceito de RNA são quase certamente
corretos. (E há ainda a tese do pré-RNA-World).
A hipótese que afirma que o RNA foi uma o
único catalisador, bem como o único replicador e por isso toda a
química básica da vida deve-se a ele, corresponde ao RNA-first, ou “genetic-first” (em contrapartida ao metabolism-first).
Esta hipótese RNA-first sofre certas
críticas do ponto de vista das descobertas bioquímica das células
modernas. Por exemplo, muitas enzimas essenciais são metaloproteínas,
que contêm centros minerais, como os aglomerados ferro-enxofre, em seu
cerne (Major et al, 2004). Há motivos, então, para acreditar que tais aglomerados – com estruturas minerais inorgânicas, como o greigita (Russell et al, 2008) – tenham raízes mais antigas do que as do RNA – seria um pré-RNA-World.
A síntese abiótica de nucleotídeos usando radiação UV e fosfato para purificar intermediários (Powner et al,
2009) parece dar suporte à ideia de que os oceanos primordiais atuavam
como um laboratório químico cheio de nucleotídeos, que polimerizaram (a
partir de íons metálicos como catalizadores) monômeros em polímeros como
o RNA, capazes de catalisar sua própria replicação e fazer
transformações orgânicas que, em última instância, produziram células
com membranas lipídicas, proteínas e DNA.
Entretanto, o fato de nucleotídeos
poderem ser sintetizados em condições não-enzimáticas ainda não é
suficiente para tornar a tese RNA-World no oceânico mais provável. Na
mesma medida, aminoácidos estão presentes em alguns meteoritos, como
encontrado no meteoro de Murchison. Análises deste meteorito
demonstraram a presença de 500 compostos orgânicos e 80 aminoácidos, 8
dos quais são preferencialmente levógiros.
A ausência de evidências geoquímicas
dificulta a aceitação da sopa primordial como a melhor hipótese. Para
dar um único exemplo, a polimerização de RNA requer energia e
concentrações elevadas de ribonucleotídeos. Não há fonte óbvia de
energia em uma sopa primordial e a radiação ionizante pode tanto
sintetizar quando destruí-los. Assim, cada vez que uma molécula de RNA
se replica, a concentração de nucleotídeos cai, a menos que os
nucleotídeos sejam reabastecidos a uma taxa igual. A radiação UV é uma
fonte de energia válida, mas ainda sim improvável para rápida
polimerização e replicação e um promotor não-promissor da seleção
natural.
Nucleotídeos e tantas outras moléculas
orgânicas não reagem muito bem em uma sopa primordial porque estão em
equilíbrio termodinâmico. Eles já reagiram, e a sopa homogênea não tem
energia-livre interna que lhes permita reagir mais. A vida não é apenas
replicação; é também um acoplamento de reações químicas exergônicas (na
qual a variação da energia livre de Gibbs padrão em condições
bioquímicas de pH 7 em uma 1 atm a 25°C tem valor negativo, indicando a
possibilidade de uma reação espontânea) que liberam energia e
endergônicos que a utilizam, evitando a dissipação de energia na forma
de calor (Veja mais em 1, 2, 3 e 4).
Em todas as formas de vida, portanto,
também no ancestral primordial, o fluxo de energia significa produzir e
quebrar ligações químicas de “alta energia”, como a ligação tioéster em
acetil-CoA ou as ligações anidrido em acetilfosfato e ATP.
Assim como Pasteur, J. B. S. Haldane
argumentou que a fermentação era o mecanismo primordial de geração de
energia, e que – nas palavras de Pasteur – a fermentação é exemplo da
“vida sem oxigênio”. Uma vez que praticamente todos os geoquímicos
concordam que havia pouco ou nenhum oxigênio livre na Terra primordial, a
fermentação nesse sentido ainda é amplamente vista como a mais provável
fonte primordial de energia. De Duve, por exemplo, argumenta que o
início da vida era anaeróbio e, portanto, mais provável de ter dependido
de tipos primordiais de fermentações.
Entretanto, tal tese sofre passa por
dificuldades, tanto químicas quanto biológicas. Observar a fermentação
como primitiva, em vez de derivada é improvável porque em tal processo
ocorre quimicamente uma desproporção – não uma reação redox simples, na
qual os elétrons são removidos de um doador e passados para um aceptor,
impulsionado por uma força termodinâmica.
A energia liberada pela fermentação é
pequena, refletindo sua fraqueza termodinâmica motriz. Tal fonte de
energia requer mais do que sofisticação energética, mas cerca de 12
enzimas são para catalisar uma sucessão de etapas glicolíticas com base
em uma via chamada de Embden-Meyerhoff.
Estas enzimas são codificadas por genes, que teriam de evoluir como uma
unidade funcional sem qualquer outra fonte de energia nos oceanos
primordiais – uma impossibilidade em um contexto de RNA-World;
considerando que seja a única maneira de evoluir. A implicação de que a
fermentação é uma derivação sofisticada, em vez de primordial, ganha
apoio da filogenética também. Nenhuma árvore evolutiva que remodelou
eventos após a origem da vida – que ocorreu há quase 4 bilhões de anos –
colocou organismos fermentadores “puros” nos ramos basais. Estes ramos
compreendem invariavelmente os prokaryotas, mas que adquirem sua energia a partir do processo quimiosmótico.
De fato, atualmente todos os autotróficos
conhecidos geram energia usando reações redox em sua membrana
plasmática, enquanto a maioria dos heterotróficos também depende de
fosforilação oxidativa – um processo no qual o oxigênio é apenas um dos
muitos possíveis receptores de elétrons terminais, como CO2 ou Fe2+. Além disso, essencialmente todos os fermentadores retém alguma maquinaria adicional de quimiosmose, nomeadamente as ATPases,
que utilizam prótons para gerar um gradiente de através da membrana
plasmática e importar e exportar solutos. Embora a fermentação não
necessite de tais membranas bioenergéticas, o transporte ativo através
da membrana celular é necessário para a homeostase e absorção de
nutrientes, bem como a motilidade flagelar (Harold, 1986).
Bactérias e archaea diferem
acentuadamente nas sequências de genes e estruturas cristalinas de
enzimas que catalisam as etapas individuais de fermentação (Siebers,
Schonheit, 2005). Em ambos os grupos são herdadas de um ancestral comum,
enquanto traços que diferem substancialmente provavelmente evoluíram
independentemente em uma fase posterior, nos dando um vislumbre simples
sobre qualidades do “último ancestral comum universal” o ‘LUCA’.
Assim, o RNA, DNA, o código genético
universal, a transcrição, tradução, ribossomos, uma ATPase do tipo
rotor-estator, ATP e o ciclo de Krebs são herdados do LUCA, enquanto
traços como a fotossíntese-oxigenada não, e só evolui mais tarde com as
cianobactérias. Neste cenário, considerando as profundas diferenças
enzimáticas que catalisam a fermentação em archaeas e bactérias, é
esmagadoramente provável que a fermentação evoluiu pelo menos duas
vezes, independentemente, nas archaeas e bactérias. O LUCA não podia
realizar fermentações de proporções da glicose – e a glicólise moderna –
que de Duve e outros sugeriram. As fermentações evoluíram mais tarde,
uma vez que os autotróficos haviam produzido compostos orgânicos para
fermentar, se alimentar e respirar.
Quando isto fica claro, uma nova pergunta
emerge: Se a fermentação é uma característica evolutivamente derivada,
então, onde estava a energia que alimentou o surgimento da vida?
Uma alternativa bastante coerente e
viável é que tal energia vinha das aberturas hidrotermais alcalinas.
Geralmente os cenários recorrem a fontes hidrotermais vulcânicas e
ácidas: os respiradouros submarinos profundos – chamados de “fumarolas
pretas” – descobertos no final dos anos 70 e que pareciam oferecer uma
boa resposta (e talvez de fato seja dependendo da linha de pesquisa). Em
contraste com a sopa orgânica, as fumarolas negras estão longe do
equilíbrio com a água do mar circundante. Essas zonas são formadas pela
interação da água do mar com o magma em 1.200°C. Seu efluente é quente
(350°C), ácido (pH 1-2), rico em sulfeto de hidrogênio e metais
dissolvidos, com baixíssimos níveis de gás hidrogênio.
A tese das fumarolas negras como local de
origem da vida é problemática, entre elas sua temperatura extrema, seu
pH baixo levando a vidas curtas deste ancestral.
As fumarolas negras não são os únicos
tipos de sistema hidrotérmico e a distinção é significativa. Um segundo
tipo de respiradouro termal, descoberto por volta dos anos 2000, (Kelley
et al, 2001) é formado pela reação da água do mar com minerais como olivina,
que compreendem grande parte da crosta oceânica. Estes sistemas
hidrotérmicos não são vulcânicos, mas resultam de um processo geoquímico
conhecido como serpentinização, em que a olivina é hidroxilada em uma
serpentina (Bach et al, 2006). As rochas hidroxiladas se
expandem e fraturam, permitindo a entrada de mais água do mar na crosta,
perpetuando a reação.
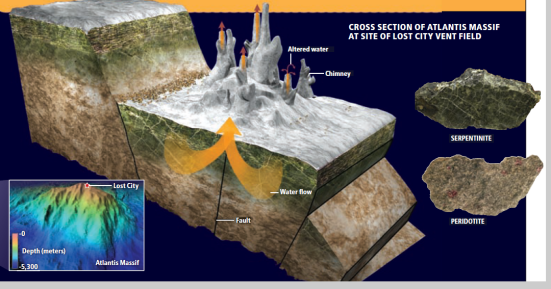
Serpentinina
A serpentinização gera temperaturas
moderadamente elevadas (150-200°C) e líquidos hidrotermais que são
fortemente alcalinos (pH 9-11) e, algo muito importante; são ricos em
hidrogênio.
A expansão térmica que ocorre nestes
locais leva os fluidos hidrotermais de volta através da crosta até o
fundo do mar, onde emergem como um tipo de ventilação radicalmente
diferente. A versão alcalina é cheia de hidrogênio dissolvido e pode ter
favorecido o surgimento da vida, como proposto por Russell et al
(1993) em quase uma década antes de sua primeira descoberta na região
do fundo do oceano chamada de ‘Lost City’ ao longo da crista do médio
atlântico (Kelley et al, 2001).
Essas “incubadoras” de proto-metabolismo –
não só eram ricas na alcalinidade dos fluidos emergentes, mas também na
sua estrutura porosa delicada. Estes sistemas suportam torres de até 60
m de altura, formadas a partir de carbonato de cálcio e crivados com
minúsculos poros interconectados em uma escala micrométrica, com paredes
de aragonita na qual fluidos hidrotérmicos circulam através de
correntes térmicas. Estes fluídos continham metano, formiato e acetato –
alguns dos quais parecem ser formados abioticamente (Bradley et al, 2009).
Independentemente da sua forma de
produção nos pontos mais profundos dentro da crosta, o metano destas
saídas alcalinas dá uma pista para a origem da vida: de que ela surgiu
como um “efeito colateral” da hidrogenação direta do dióxido de carbono,
para formar metano ou acetato. Uma evidência disto é que todos os seres
autótrofos hoje corrigem dióxido de carbono usando hidrogênio, direta
ou indiretamente (da água ou de outros doadores de elétrons como H2S), e há somente 5 rotas primarias conhecidas de fixação de carbono. Destas, 4 consomem energia em forma de trifosfato de adenosina (ATP) para fixar o carbono. A exceção é a via acetil-CoA (Wood-Ljungdahl) de reação direta de hidrogênio com o dióxido de carbono.
Esta via é encontrada em alguns dos
procariotos mais antigos, incluindo os metanogênicos (como as archaea) e
os acetogênios (bactérias), e assim é provável que tenham estado
presentes em LUCA também.
Este caminho antigo simultaneamente fixa carbono ao gerar energia como ATP – “como um free luch, em que você é pago para comer” nas palavras de Everett Shock. (Shock et al,
1998) Em ambos os grupos (metanógenos e acetogênicos), as etapas de
redução de carbono são catalisadas por metaloenzimas com clusters
minerais contendo ferro, enxofre e níquel em seus centros. As estruturas
cristalinas desses aglomerados são essencialmente as de minerais
encontrados em fontes hidrotermais, como o greigita, (Major et al, 2004 & Russell, 2004) até o ponto em que se poderia referir à via acetil-CoA como tendo “raízes rochosas”.
Quando a vida surgiu e as concentrações de CO2
nos oceanos eram 1.000 vezes mais elevadas do que as atuais, as
aberturas alcalinas foram o local de uma interface redox entre fontes
hidrotermais ricas em H2 e fases aquosas marinhas. A ausência de oxigênio significava que os oceanos estavam cheios de Fe2+
dissolvido fazendo com que as “células minerais” em aberturas alcalinas
fossem limitadas por membranas inorgânicas borbulhantes em vez de (ou
em adição) a aragonita. Exemplos de depósitos minerais vesiculares de
sulfureto metálico são encontrados hoje em aberturas datadas em mais de
360 milhões de anos, na região de Tynagh na Irlanda (Russell et al,
1994). Esses sulfuretos metálicos de transição são ricos e capazes de
realizar funções catalíticas, supostamente dando tais competências nas
paredes dos compartimentos inorgânicos naturais. Considerando que essas
aberturas alcalinas teriam estado presentes em grande escala sobre o
fundo do mar é possível cogitar tal processo como ligado a origem da
vida.

Localização geográfica de Lost City. Entre o continente americano e Africano.
A química abiótica prevista para as
fontes alcalinas, tanto termodinâmica como experimentalmente, fornecem
fortes indicações de como a vida pode ter começado e por que a
quimiosmose sempre foi o principal processo de conversão de energia.
Sua origem em respiradouros alcalinos
sendo favorável a produção de energia gera o motor da via metabólica
primordial da vida a partir da transferência de elétrons de H2 para CO2. A formação de metano ou acetato a partir de H2 e CO2
libera a energia que microrganismos metanógenos e acetogênicos
aproveitam para manter suas vias biossintéticas. Uma porção da energia
libertada na via acetil-CoA é capturada na forma de ligação tioéster de
alta energia.
Esta via é tão antiga (e provavelmente a
via mais evidente de evoluir) quanto ás outras propriedades bioquímicas
(Fuchs & Stupperich, 1985) e permanece atual entre os
microbiologistas evolucionistas (Ljungdahl, 2009). Organismos
metanógenos convertem duas moléculas de CO2 em acetil-CoA sem
a participação de ATP ou qualquer outro trifosfato. Os sulfetos de
metais de transição são abundantes nos metanogênos da via de acetil-CoA,
(Russell, 2004) mas a corrente de energia universal ATP está ausente.
Neste caso, a acetil-CoA (e tantos outros
tioésteres) são centrais para a via bioenergética e bioquímicas mais
primitivas, sendo a via acetil-CoA o melhor exemplo. Isto significa que
enquanto o acetil-CoA em si é bastante complexo, os tioésteres de acetil
mais simples podem ter desempenhado um papel equivalente ao acetil-CoA
na bioquímica primordial (de Duve, 2002 & 2005; Martin &
Russell, 2007).
Os tioésteres de acetil foram
sintetizados em condições alcalinas utilizando catalisadores de FeS ou
NiS inorgânicos como já demonstrado por Huber e Wächtershäuser. (Huber,
1997)
Além disso, as ligações de tioéster de
“alta energia” são facilmente convertidas nas ligações de fosfato do ATP
na bioquímica moderna. Em condições primordiais, os acetil tioésteres
análogos ao acetil-CoA podem por sua vez reagir com fosfato inorgânico
para gerar acetil-fosfato, (de Zwart et al, 2004) que também é
rico em energia e funcional tal como o ATP, que ainda é usado em algumas
bactérias. Em termos de fontes primordiais de energia, então, é
provável que a moeda energética comum da vida – o ATP – tenha sido
precedida nas aberturas alcalinas por uma moeda intercambiável mais
simples de tioésteres de acetil e fosfato de acetil. Assim, a via
acetil-CoA gera tanto produtos orgânicos simples, como piruvato, bem
como o fosfato de acetil para conduzir o ciclo de ácido cítrico redutivo
e, de forma mais ampla, constitui um metabolismo intermediário mais
amplo.
Estas vias são tratadas em vários outros artigos (Morowitz et al,
2000; Martin & Russell, 2007; Wachtershauser, 2006) destacando que o
processo de serpentinização gera outros compostos reduzidos além do
hidrogênio em si, onde o poder de redução desses sistemas hidrotérmicos é
suficiente para fixar N2 como amoníaco, (Smirnov et al,
2008) permitindo assim a síntese de intermediários iniciais no
metabolismo de nitrogênio necessário para a produção de aminoácidos e
nucleotídeos. A síntese de aminoácidos em condições hidrotermais já foi
demonstrada (Huber & Wachtershauser, 2003), assim como a síntese de
hidrocarbonetos hidrofóbicos de cadeia longa (possíveis precursores de
membranas biológicas) através de reações de Fischer-Tropsch (Cody,
2004).
Ainda não se demonstrou a síntese
abiótica de bases nucleotídicas em condições de ventilação hidrotérmica,
apesar de o FeS catalisar eficazmente a síntese de purinas e
pirimidinas a partir de formamida em laboratório (Saladino et al, 2008).
O problema principal para a acumulação
dos nucleotídeos adenina (A), uracila (U), guanina (G), citosina (C) e
timina (T) nos primórdios da Terra está em sua rápida taxa de degradação
a elevadas temperaturas. No entanto, várias considerações feitas com
base em evidências das condições quentes no início da evolução da Terra
levaram a sugerir que a vida se originou sob a alta temperatura (80 ±
110°C ou superior até 350°C) (Pace, 1991).
Estas considerações levaram à conclusão
de que a origem da vida baseada em um código de quatro letras e em
compostos básicos só seria possível se ocorresse muito rapidamente
(<100 a="" anos="" baixas="" cido="" condensa="" de="" deos="" dos="" e="" em="" estabilizador="" f="" forma="" formamida="" hcn="" hidrolisa="" isso="" micro-ambiente.="" na="" nucleot="" o="" odrington="" onde="" permitiria="" presen="" que="" relativamente="" rmico="" temperaturas="" um="">et al
, 1966) e assim seria possível um adicional candidato para a síntese de nucleotídeos (Miller, 1987 & Miller, 1955).
Estudos pioneiros têm demonstrado que as
bases purínicas podem ser sintetizadas a partir da formamida pura quando
tratada a alta temperatura (Bredereck et al, 1959) e estudos
de acoplamento de adenina feitos com cianeto de potássio enriquecido
indicam claramente a presença de ambas moléculas, HCN e formamida na
adenina (Yamada et al, 1978). A síntese de purina e pirimidina a
partir de derivados de formamida sob condições catalíticas
proporcionaria uma rota pré-biótica mais eficiente. Sílica, alumina, e
óxidos metálicos como a perovskitas, espinélios, argilas e zeólitas,
estavam presentes na Terra primitiva. Estes óxidos inorgânicos já
demonstraram ter grande valor em uma gama de transformações catalíticas
abióticas devido a propriedades ácidas ou básicas, a capacidade de troca
catiônica e para a possibilidade de acomodar quantidades de água ou
outras moléculas (Thomas et al, 1997).
Um estudo realizado por Saladino et al
(2001) demonstrou que a condensação de formamida poderia ter formado
(na presença de óxidos inorgânicos) as bases do DNA e pode fornecer um
quadro plausível pré-biótico para a síntese de derivados de purina e
pirimidina. Este hipótese satisfaz alguns dos pré-requisitos básicos e
necessários para a evolução química pré-biótica.
Uma solução alternativa poderia vir
também da condensação de nucleotídeos ainda desconhecida e que ocorresse
de forma rápida, do ponto de vista competitivo, que torna os
nucleotídeos mais estáveis criando estruturas moleculares de ordem
superior. Na falta de soluções experimentalmente verificáveis para este
viés, a formamida para a síntese de nucleotídeos descrita por Saladino
deve ser considerada como a melhor possibilidade química para processos
pré-bióticos (Veja mais em Pré-Bioticidade – A Síntese do Cianoacetileno, Cianoacetaldeido, bases pirimídicas e púricas).
A síntese de bases de ribonucleotídeos é
termodinamicamente favorável em condições hidrotermais (LaRowe &
Regnier, 2008). Parece plausível, então, que os nucleotídeos pudessem
ter sido formados sob condições abióticas em respiradouros alcalinos,
devido a fonte contínua de hidrogênio e dióxido de carbono, as
propriedades catalíticas de íons metálicos de transição (sulfuretos), e a
capacidade dos compartimentos inorgânicos para concentrar
intermediários. Os catalisadores podem ter um efeito profundo no
resultado das reações favorecendo algumas delas sobre outras, dando
origem a vias proto-metabólicas, minimizando a contaminação com outros
produtos.
A cinética da reação (velocidades do
processo) e o controle termodinâmico (ganhos de produto mais estáveis)
determinam a natureza das primeiras vias bioquímicas, em grande parte
pela natureza dos catalisadores envolvidos – e esses caminhos forneceram
os produtos necessários para a seleção começar a operar em um RNA. Se
há material genético e a termodinâmica canaliza a química para o
material genético sob os tipos certos de condições, então há a versão
química da seleção natural atual, do modo como os biólogos estão
acostumados a observar.
A polimerização e replicação de
nucleotídeos primitivos em um RNA-world é mais facilmente visível em
respiradouros do que como fruto da ação da radiação em uma sopa
primordial. Braun e outros colegas pesquisadores (Baaske et al,
2007) mostraram em uma simulação que as correntes de convecção e a
difusão térmica tendem a concentrar nucleotídeos nas regiões mais frias
do sistema de ventilação em até milhões de vezes a concentração inicial,
tornando a polimerização em RNA ou DNA muito mais provável,
especialmente na presença de uma fonte contínua de ligações de
fosfoanidrido. Ácidos nucleicos com até 100 bases de comprimento mostram
uma propensão ainda maior a se concentrar, teoricamente formando um
trilhão de vezes a concentração inicial.
A circulação térmica também tende a
derreter e reaquecer ácidos nucleicos, simulando sua amplificação por
PCR convectiva (Baaske et al, 2007), indicando que a formação e
replicação de RNA são positivamente favorecidas em respiradouros
alcalinos, cujos interiores estão próximos a um mundo ideal para o RNA
sobreviver. As altas pressões parciais do dióxido de carbono teriam
feito uma diferença considerável em um oceano ácido. Os oceanos ácidos
fizeram os respiradouros alcalinos inerentemente quimiosmóticos levando a
um gradiente natural de prótons através das membranas inorgânicas,
produzindo provavelmente a força motriz do próton de aproximadamente 200
mV, (Russell & Hall, 1997) exterior positiva, similar na magnitude
àquela através das membranas biológicas atuais. Sendo constantemente
reabastecida por fluidos alcalinos que emanam das aberturas, e o
gradiente de prótons tinha uma polaridade idêntica à das células de
modernas.
Assim, as fontes hidrotermais alcalinas
podem fornecer um meio alternativo para entender como a vida se originou
e destaca a quimiosmose como um mecanismo simples e que atuou como uma
via bioenergética em favor da vida.
Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.