Introdução
Do
que seu corpo é feito? Sua primeira ideia pode ser que ele é feito de
diferentes órgãos—como seu coração, pulmões e estômago—que trabalham
juntos para manter seu corpo funcionando. Ou você pode aprofundar um
nível e dizer que seu corpo é formado por diferentes tipos de células.
Contudo, no nível mais básico, seu corpo—e toda a vida e o mundo não
vivo—é feito de átomos, geralmente organizados em estruturas maiores,
chamadas de moléculas.
Átomos
e moléculas respeitam as leis da química e da física, mesmo quando
fazem parte de um ser vivo complexo. Se você aprendeu em química que
alguns átomos tendem a ganhar ou perder elétrons, ou a formar ligações
entre si, esses fatos continuam sendo verdadeiros mesmo quando os átomos
e moléculas são parte de um ser vivo. Na verdade, interações simples
entre átomos - que ocorrem várias vezes e em diversas combinações, em
uma única célula ou organismo - é o que torna a vida possível. Pode-se
dizer que tudo o que você é, incluindo sua consciência, é subproduto de
interações químicas e elétricas entre um grande número de átomos não
vivos.
Então,
como um incrível complexo ser, composto por aproximadamente
7.000.000.000.000.000.000.000.000.000 de átomos, você provavelmente irá
querer saber o básico de química ao explorar o mundo da biologia e o
mundo em geral.
Matéria e elementos
O termo matéria
se refere a qualquer coisa que ocupe espaço e tenha massa - em outras
palavras, as "coisas" das quais o universo é feito. Toda matéria é
composta por substâncias chamadas elementos, que possuem propriedades
químicas e físicas especificas e não podem ser quebradas em outras
substâncias através de uma simples reação químicas. O ouro, por exemplo,
é um elemento, assim como o carbono. Existem 118 elementos, mas apenas
92 ocorrem naturalmente. Os demais elementos existem apenas quando
produzidos em laboratório e são instáveis.
Cada
elemento é representado por seu símbolo químico, que é um única letra
maiúscula, ou quando uma letra já é usada por outro elemento, uma
combinação de duas letras. Alguns elementos seguem o termo em português
para aquele elemento, como C para carbono e Ca para cálcio. O símbolo
para outros elementos vem do seu nome em latim, por exemplo, o símbolo
para sódio é Na, que é a abreviação de natrium, o termo em latim para sódio.
Os
quatro elementos comuns a todos os seres vivos são oxigênio (O),
carbono (C), hidrogênio (H) e nitrogênio (N), que juntos compõem cerca
de 96% do corpo humano. No mundo inanimado, elementos são encontrados em
proporções diferentes, e alguns elementos comuns nos seres vivos são
relativamente raros na Terra como um todo. Todos os elementos e as
reações químicas entre eles obedecem às mesmas leis da química e da
física, independente se eles fazem parte de seres vivos ou não vivos.
A estrutura do átomo
Um átomo
é a menor unidade da matéria que conserva todas as propriedades de um
elemento. Por exemplo, uma moeda de ouro é simplesmente um número muito
grande de átomos de ouro moldados no formato de uma moeda, com pequenas
quantidades de outros elementos contaminantes. Átomos de ouro não podem
ser quebrados em nada menor e ainda manter as propriedades do ouro. Um
átomo de ouro tem suas propriedades provenientes de pequenas partículas
subatômicas das quais é composto.
Um átomo consiste de duas regiões. A primeira é o pequeno núcleo atômico, que está no centro do átomo e contém partículas carregadas positivamente chamadas prótons e partículas neutras e não carregadas chamadas nêutrons. A segunda região, muito maior, é uma "nuvem" de elétrons,
partículas carregadas negativamente que orbitam ao redor do núcleo. A
atração entre prótons carregados positivamente e elétrons carregados
negativamente mantém o átomo unido. A maioria dos átomos contém todas os
três tipos de partículas subatômicas - prótons,
elétrons e nêutrons. O hidrogênio (H) é uma exceção porque, tipicamente,
tem um próton e um elétron, mas não tem neutrons. O número de prótons
no núcleo determina de qual elemento um átomo é, enquanto o número de
elétrons ao redor do núcleo determina que tipo de reações o átomo fará.
Os três tipos de partículas subatômicas são ilustrados abaixo em um
átomo de hélio - que, por definição, contém dois prótons.
Prótons e nêutrons não têm a mesma carga, mas eles têm aproximadamente a mesma massa, cerca de 1, comma, 67, ×, 10, start superscript, minus, 24, end superscript
gramas. Como o grama não é uma unidade muito conveniente para medir
massas tão pequenas, os cientistas definiram uma unidade alternativa, o dalton ou unidade de massa atômica
(amu). Um único nêutron ou próton tem peso bem próximo ao de 1 u. Os
elétrons são muito menores em massa que os prótons, cerca de apenas
1/1800 de uma unidade de massa atômica, portanto eles não contribuem
muito para a massa atômica total de um elemento. Por outro lado, os
elétrons afetam muito a carga do átomo, pois cada elétron tem uma carga
negativa igual à carga positiva de um próton. Em átomos neutros sem
carga, o número de elétrons orbitando ao redor do núcleo é igual ao
número de prótons dentro do núcleo. As cargas positivas e negativas se
neutralizam, levando a um átomo sem carga resultante.
Prótons,
nêutrons e elétrons são muito pequenos, e a maioria do volume de um
átomo—mais de 99 por cento—é, na verdade, espaço vazio. Com todo esse
espaço vazio, você talvez queira saber porque os chamados objetos
sólidos não atravessam uns aos outros. A resposta é que as nuvens de
elétrons de carga negativa dos átomos repelem-se entre si se chegarem
muito perto, resultando em nossa percepção de solidez.
Introdução
A
radioatividade aparece com bastante frequência nos noticiários. Você já
pode ter lido sobre isto em discussões acerca da energia nuclear, da
tragédia do reator nuclear de Fukushima ou do desenvolvimento de armas
nucleares. Ela também aparece na cultura popular: a origem de muitos dos
super heróis das histórias envolve, por exemplo, sua exposição à
radiação ou, no caso do Homem Aranha, uma picada de aranha radioativa.
Mas o que exatamente significa ser radioativo?
A
radioatividade é na verdade uma propriedade do átomo. Átomos
radioativos têm núcleos instáveis que liberam partículas subatômicas
para se tornarem mais estáveis, emitindo energia - radiação - durante o
processo. Muitas vezes os elementos se apresentam em duas versões,
radioativa e não radioativa, que diferem pelo número de nêutrons que
eles contêm. Essas versões diferentes dos elementos são chamadas
isótopos e os isótopos radioativos geralmente aparecem em pequena
quantidade na natureza. Por exemplo, uma pequena quantidade do carbono
existente na atmosfera é carbono-14 radioativo e a quantidade de
carbono-14 encontrada nos fósseis permite aos paleontólogos a
determinação de suas idades.
Neste
artigo, veremos em mais detalhes as partículas sub atômicas que os
diferentes átomos contêm e também o que faz um isótopo ser radioativo
Número atômico, massa atômica e massa atômica relativa
Os
átomos de cada elemento contêm um número característico de prótons. O
número de prótons determina qual o átomo (p.e., todos os átomos com seis
prótons, são átomos de carbono); o número de prótons num átomo é
chamado de número atômico. Em contraste, o número de
nêutrons de um elemento pode variar. Formas do mesmo elemento que
diferem apenas em seu número de nêutrons são chamadas isótopos. Juntos, o número de prótons e o número de nêutrons determinam num elemento a sua massa atômica:
massa atômica = prótons + nêutrons. Se você quiser calcular quantos
nêutrons tem um átomo, você deve subtrair o número de prótons, ou seja o
número atômico, do número de massa daquele átomo .
Uma propriedade intimamente relacionada ao número de massa de um átomo é sua massa atômica.
A massa atômica de um único átomo é sua massa total e é tipicamente
expressa em unidades de massa atômica ou u. Por definição, um átomo de
carbono com seis nêutrons, carbono-12, tem um número de massa de 12 u.
Outros átomos geralmente não têm um número de massa atômica redondo, por
razões que estão além do contexto deste artigo. Em geral, embora a
massa atômica de um átomo seja muito próxima de seu número de massa, ela
terá algum um desvio nas casas decimais.
Uma vez que os isótopos de um elemento têm diferentes massas atômicas, os cientistas podem determinar a massa atômica relativa—também chamada de peso atômico—de
um elemento. A massa atômica relativa é a média das massas atômicas de
todos os diferentes isótopos de uma amostra, na qual cada contribuição
de um isótopo, é determinada pelo montante da sua contribuição para a
média. A massa atômica relativa dada na tabela periódica—como a do
hidrogênio, abaixo—é calculada para todos os isótopos de cada elemento,
que ocorrem naturalmente, de acordo com a abundância desses isótopos na
Terra. Objetos extraterrestres, como asteroides, ou meteoros podem ter
abundâncias isotópicas relativas muito diferentes.
Isótopos e decaimento radioativo
Como
mencionado acima, os isótopos são as diferentes formas de um elemento,
eles têm o mesmo número de prótons, mas números diferentes de nêutrons.
Muitos elementos — tais como o carbono, potássio e urânio — possuem
vários isótopos naturais. Um átomo neutro de carbono-12 contém 6
prótons, 6 nêutrons e seis elétrons; portanto tem um número de massa de
12 (seis prótons e seis nêutrons). O carbono neutro-14 contém seis
prótons, oito nêutrons seis elétrons; seu número de massa é 14 (seis
prótons e oito nêutrons). Estas duas formas alternativas de carbono são
isótopos.
Alguns
isótopos são estáveis, mas outros podem emitir ou expulsar partículas
sub atômicas para atingir uma configuração menos energética mais
estável. Tais isótopos são chamados de radioisótopos, e o processo pelo qual liberam partículas e energia é conhecido como decaimento.
O decaimento radioativo pode causar uma mudança no número de prótons no
núcleo; quando isto acontece, a identidade do átomo muda (p.e.,
carbono-14 decaindo para nitrogênio-14).
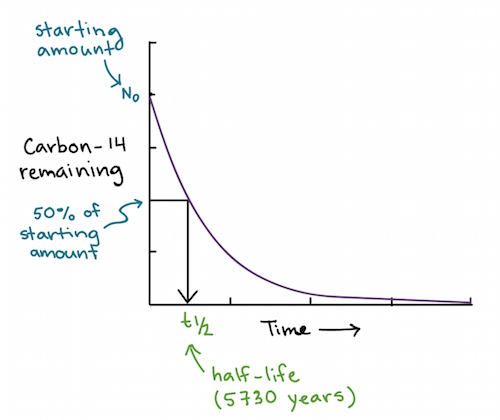
O decaimento radioativo é um processo aleatório mas exponencial, e a meia-vida
de um isótopo é o período no qual metade do material decairá para um
produto diferente, relativamente mais estável. A proporção do isótopo
original para seu produto após o decaimento e para isótopos estáveis é
previsível; essa previsibilidade permite que a abundância relativa dos
isótopos seja utilizada como um relógio que mede o tempo da incorporação
do isótopo (p.e., num fóssil) até o presente.
Por
exemplo, o carbono está normalmente presente na atmosfera na forma de
gases como dióxido de carbono e existe em três formas isotópicas:
carbono-12 e carbono-13, que são estáveis, e carbono-14, que é
radioativo.
Essas formas de carbono são encontradas na atmosfera em
proporções relativamente constantes, com carbono-12 como a principal
forma com aproximadamente 99%, carbono-13 como a menor, cerca de 1%, e
carbono-14 presente apenas em quantidades muito pequenasstart superscript, 1, end superscript.
Uma vez que as plantas retiram o dióxido de carbono do ar para produzir
açúcares, a quantidade relativa de carbono-14 em seus tecidos é igual à
concentração de carbono-14 da atmosfera. Já que os animais alimentam-se
de vegetais, ou de outros animais que se alimentaram de vegetais, as
concentrações de carbono-14 em seus corpos também vão se igualar à
concentração atmosférica. Quando um organismo morre, ele para de
absorver carbono-14, assim, a proporção de carbono-14 para carbono-12 em
seus restos, tais como ossos fossilizados, vai diminuir à medida que o
carbono-14 gradualmente decair para nitrogênio-14squared.
Após
uma meia vida de aproximadamente 5.730 anos, metade do carbono-14 que
estava inicialmente presente terá se convertido a nitrogênio-14. Essa
propriedade pode ser utilizada para datar restos de seres vivos, como
ossos antigos ou madeira.
Comparando-se a razão das concentrações de
carbono-14 para carbono-12 de um objeto, com a mesma razão na atmosfera,
equivalente à concentração inicial no objeto, pode-se determinar a
fração do isótopo que ainda não decaiu. Com base nesta fração, a idade
do material pode ser calculada com precisão se ele não for muito mais
antigo que 50.000 anos.
Outros elementos têm isótopos com diferentes
meias vidas e podem ser utilizados para avaliar a idade em diferentes
escalas de tempo. Por exemplo, o potássio-40 tem meia vida de 1,25
bilhão de anos e o urânio-235 tem meia vida de cerca de 700 milhões de
anos e tem sido utilizado para avaliar a idade das rochas lunaressquared.
Introdução
Em
algum momento em seu aprendizado de química você deve ter conhecido
alguma canção que ajudasse a memorizar os nomes de todos os elementos.
Assim como eu, pode ser que você tenha conseguido decorar a tal canção
com o intuito de tirar uma boa nota. Se foi esse o caso, é possível que
você ainda se lembre dos nomes de todos os elementos, o que é um feito
impressionante (sem contar que é uma ótima música para se cantar em
festas!).
Se
você tiver memorizado todos os nomes dos elementos, isso significa que
você nunca mais vai precisar de uma tabela periódica? Bem... Acho que
não. Isso porque a tabela periódica não é um balde que contém todos os
elementos. Ao invés disso, é mais como um sistema de arquivos. A posição
de cada elemento na tabela nos tá informações importantes sobre sua
estrutura, propriedades e comportamento em reações químicas.
Especificamente, a posição de um elemento na tabela periótica ajuda a
descobrir sua configuração eletrônica, a maneira como os elétrons estão
organizados em volta do núcleo. Os átomos usam seus elétrons para
participar em reações químicas, assim se sabemos a configuração
eletrônica de um elemento, podemos prever sua reatividade - se, e como,
ele interage com os átomos de outros elementos.
Neste
artigo, vamos estudar a tabela periódica mais detalhadamente, como os
átomos organizam seus elétrons, e como isso nos permite prever a
reatividade dos elementos.
A tabela periódica
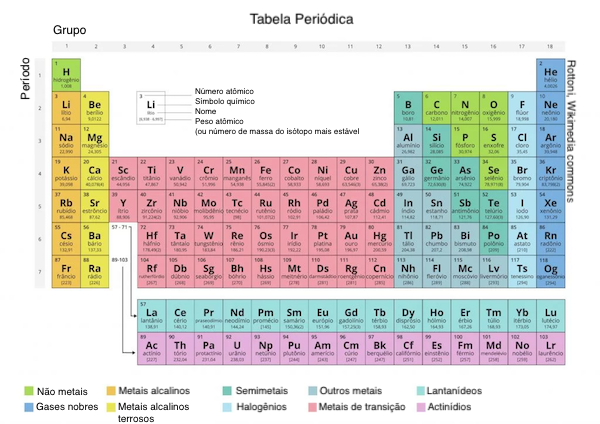
Por convenção, os elementos são organizados na tabela periódica,
que é uma estrutura com padrões importantes que se relacionam com seu
comportamento. Desenvolvida pelo químico russo Dmitri Mendeleev
(1834-1907) em 1869, a tabela organiza os elementos em colunas - grupos - e linhas - períodos
- que compartilham algumas propriedades. Essas propriedades determinam o
estado físico de um elemento a temperatura ambiente - gás, sólido ou
líquido - bem como sua reatividade química, ou seja, sua habilidade de formar ligações químicas com outros átomos.
Além
de listar o número atômico para cada elemento, a tabela periódica
também mostra a massa atômica relativa do elemento, que é a média de
peso dos seus isótopos que ocorrem naturalmente na Terra. Olhando para o
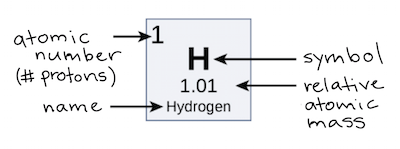
hidrogênio, por exemplo, seu símbolo, start text, H, comma, end text e nome aparecem, bem como seu número atômico um—no canto superior esquerdo—e sua massa atômica relativa de 1,01.
As
diferenças de reatividade química entre elementos baseiam-se no número e
na distribuição espacial de seus elétrons. Se dois átomos têm padrões
eletrônicos complementares, eles podem reagir e formar uma ligação
química, criando uma molécula ou um composto. Como vamos ver a seguir, a
tabela periódica organiza os elementos de forma que isso reflita seu
número e padrão de elétrons, o que faz com que a tabela seja útil para
prever a reatividade de um elemento: qual a probabilidade deste elemento
formar ligações, e com quais outros elementos.
Camadas eletrônicas e o modelo de Bohr
Um
dos modelos iniciais do átomo foi desenvolvido em 1913 pelo cientista
dinamarquês Niels Bohr (1885-1962). O modelo de Bohr mostra o átomo como
um núcleo central contendo prótons e nêutrons, com os elétrons em
camadas eletrônicas circulares a distâncias específicas do núcleo,
similar aos planetas orbitando o sol. Cada camada eletrônica tem um
diferente nível de energia, com as camadas mais próximas do núcleo sendo
de menor energia do que as mais distantes do núcleo. Por convenção, é
designado um número e o símbolo n para cada camada—por exemplo, a camada
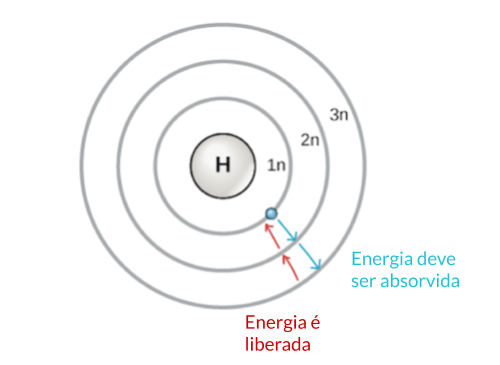
eletrônica mais próxima do núcleo é chamada de 1n. De modo a se mover
entre as camadas, um elétron deve absorver ou liberar uma quantidade de
energia exatamente correspondente à diferença de energia entre as
camadas. Por exemplo, se um elétron absorver energia de um fóton, pode
tornar-se excitado e mover-se para uma camada de maior energia;
inversamente, quando um elétron excitado retorna a uma camada de menor
energia, ele libera energia, comumente na forma de calor.
Átomos,
como outras coisas governadas pelas leis da física, tendem a assumir a
configuração mais estável e de menor energia que conseguirem. Assim, as
camadas eletrônicas de um átomo são ocupadas de dentro para fora, com os
elétrons preenchendo as camadas de menor energia perto do núcleo antes
de irem para as camadas mais distantes de maior energia. A camada mais
próxima do núcleo, 1n, pode conter dois elétrons, enquanto a próxima
camada, 2n, pode conter oito, e a terceira camada, 3n, pode conter até
18.
O
número de elétrons na camada mais externa de um determinado átomo
determina a sua reatividade, ou tendência de formar ligações químicas
com outros átomos. A camada mais externa é conhecida como camada de valência, e os elétrons nela encontrados são chamados de elétrons de valência.
Geralmente, os átomos estão mais estáveis, menos reativos, quando sua
camada mais externa está cheia. A maioria dos elementos importantes em
biologia necessitam de oito elétrons em sua camada mais externa para que
se tornem estáveis, e esse princípio prático é conhecido como a regra do octeto
. Alguns átomos podem ser estáveis com um octeto mesmo que sua camada
de valência seja a camada 3n, que pode conter até 18 elétrons. Nós
exploraremos a razão disso quando discutirmos orbitais eletrônicos
abaixo.
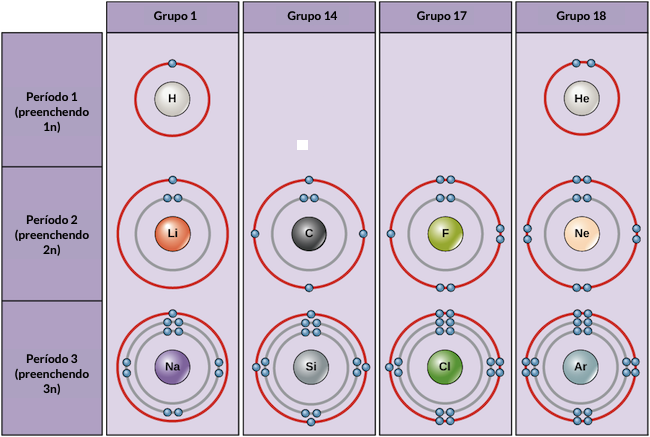
Exemplos
de alguns átomos neutros e suas configurações eletrônicas estão
mostrados abaixo. Nesta tabela, você pode ver que o hélio tem a camada
de valência cheia, com dois elétrons em sua primeira e única camada, 1n.
Semelhantemente, o neônio tem uma camada externa 2n completa contendo
oito elétrons. Essas configurações eletrônicas tornam o hélio e o neônio
muito estáveis. Embora o argônio tecnicamente não tenha uma camada
externa cheia, visto que a camada 3n pode conter até dezoito elétrons,
ele é estável como o neônio e o hélio porque ele tem oito elétrons na
camada 3n e, portanto, satisfaz a regra do octeto. Diferentemente, o
cloro tem apenas sete elétrons em sua camada mais externa, enquanto o
sódio tem apenas um. Esse padrões não preenchem a camada mais externa
nem satisfazem a regra do octeto, fazendo com que sódio e cloro sejam
reativos, ávidos para ganhar ou perder elétrons para atingirem uma
configuração mais estável.
Configurações eletrônicas e a tabela periódica
Os
elementos são ordenados na tabela periódica de acordo com seu número
atômico, a quantidade de prótons que eles têm. Em um átomo neutro, o
número de elétrons é igual ao número de prótons, então é fácil
determinar o número de elétrons pelo número atômico. Além disso, a
posição de um elemento na tabela periódica - sua coluna ou grupo e sua
fileira ou período - nos dão informações muito úteis sobre como esses
elétrons estão organizados.
Se
considerarmos apenas as três primeiras linhas da tabela, que incluem os
principais elementos importantes para a vida, cada linha corresponde ao
preenchimento de uma camada eletrônica diferente: hélio e hidrogênio
colocam seus elétrons na camada 1n, enquanto elementos da segunda linha,
como Li, começam a preencher a camada 2n e elementos da terceira linha,
como Na, continuam com a camada 3n. Semelhantemente, o número da coluna
de um elemento dá informação acerca do seu número de elétrons de
valência e reatividade. Em geral, o número de elétrons de valência é o
mesmo dentro de uma coluna e aumenta da esquerda para a direita dentro
de uma linha. Elementos do grupo 1 têm apenas um elétron de valência e
elementos do grupo 18 têm oito, com exceção do hélio, que tem somente
dois elétrons no total. Assim. o número do grupo é um bom preditor do
quão reativo cada elemento será:
- Hélio (start text, H, e, end text), neônio (start text, N, e, end text), e argônio (start text, A, r, end text), como elementos do grupo 18, têm camadas eletrônicas externas que estão cheias ou que satisfazem a regra do octeto. Isso os torna altamente estáveis como átomos individuais. Por causa de sua não-reatividade, eles são chamados de gases inertes ou gases nobres.
- Hidrogênio (start text, H, end text), lítio (start text, L, i, end text), e sódio (start text, N, a, end text), como elementos do grupo 1, têm apenas um elétron na camada de valência. Eles são instáveis como átomos individuais, mas podem se tornar estáveis perdendo ou compartilhando o elétron de valência. Se esses elementos perderem completamente um elétron—como start text, L, i, end text e start text, N, a, end text tipicamente fazem—eles se tornam íons positivamente carregados: start text, L, i, end text, start superscript, plus, end superscript and start text, N, a, end text, start superscript, plus, end superscript.
- Flúor (start text, F, end text) e cloro (start text, C, l, end text), como elementos do grupo 17, têm sete elétrons na camada de valência. Eles tendem a atingir um octeto completo tirando um elétron de outros átomos, tornando-se íons negativamente carregados: start text, F, end text, start superscript, minus, end superscript and start text, C, l, end text, start superscript, minus, end superscript.
- O Carbono (start text, C, end text), como um elemento do grupo 14, tem quatro elétrons na camada de valência. O carbono tipicamente compartilha elétrons para atingir uma camada de valência completa, formando ligações com vários outros átomos.
Assim,
as colunas da tabela periódica refletem o número de elétrons
encontrados na camada de valência de cada elemento, que, por sua vez,
determina como este vai reagir.
Subcamadas e orbitais
O
modelo de Bohr é útil para explicar a reatividade e ligação química de
vários elementos, mas na verdade, ele não fornece uma descrição muito
precisa de como os elétrons estão distribuídos espacialmente ao redor do
núcleo. Especificamente, os elétrons não circulam realmente ao redor do
núcleo, mas passam a maior parte do tempo em regiões de formato às
vezes complexo do espaço ao redor do núcleo, conhecidas como orbitais eletrônicas.
Não é possível, de fato, saber onde um elétron se encontra em um
determinado momento, mas podemos determinar matematicamente o volume
espacial onde há maior probabilidade de ele se encontrar (digamos, o
volume espacial no qual ele vai passar 90% de seu tempo). Esta região de
alta probabilidade compõe uma orbital, e cada orbital pode conter até
dois elétrons.
Então,
como estes orbitais definidos matematicamente se encaixam nas camadas
eletrônicas vistas no modelo de Bohr? Podemos decompor cada camada
eletrônica em uma ou mais subcamadas, que são simples conjuntos de um ou
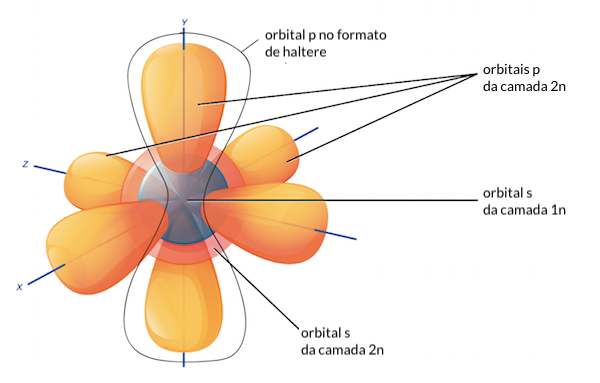
mais orbitais. As subcamadas são designadas pelas letras s, p, d e f, e cada letra indica um formato diferente. Por exemplo, as subcamadas s possuem um único orbital esférico, enquanto que as subcamadas p
contêm três orbitais em formato de halteres posicionados em ângulo reto
entre si. A maior parte da química orgânica - a química dos compostos
do elemento carbono, que são centrais em biologia - envolve interações
entre os elétrons nas subcamadas s e p,
por isso estes são os tipos de subcamada mais importantes a serem
estudados. Entretanto, átomos com muitos elétrons podem colocar alguns
de seus elétrons nas subcamadas d e f. As subcamadas d e f possuem formatos mais complexos e contêm cinco e sete orbitais, respectivamente.
A primeira camada eletrônica, 1n, corresponde a um único orbital 1, s . O orbital 1, s
é o mais próximo do núcleo e é o primeiro a ser preenchido com
elétrons, antes de qualquer outro orbital. O hidrogênio possui apenas um
elétron, então, ele tem apenas uma posição preenchida no orbital 1, s. Isto pode ser escrito de forma abreviada chamada de configuração eletrônica como 1, s, start superscript, 1, end superscript, onde o 1 sobrescrito refere-se ao um elétron no orbital 1, s. O hélio tem dois elétrons, então, ele preenche completamente o orbital 1, s com seus dois elétrons. Isto é escrito como 1, s, squared, referindo-se aos dois elétrons de hélio no orbital 1, s.
Na tabela periódica, o hidrogênio e o hélio são os dois únicos
elementos na primeira linha, ou período, o que significa que eles
possuem elétrons apenas em sua primeira camada. O hidrogênio e o hélio
são os dois únicos elementos que têm elétrons exclusivamente no orbital 1, s em seu estado neutro, sem carga.
A segunda camada eletrônica, 2n, contém outro orbital esférico s e mais três orbitais p em forma de halteres, cada um podendo conter dois elétrons. Após o preenchimento do orbital 1, s, a segunda camada eletrônica começa a ser preenchida, com os elétrons indo primeiro para o orbital 2, s e depois para os três orbitais p.
Os elementos da segunda linha da tabela periódica colocam seus elétrons
na camada 2n, bem como na camada 1n. Por exemplo, o lítio (Li) possui
três elétrons: dois preenchem o orbital 1, s e o terceiro é colocado no orbital 2, s, formando uma configuração eletrônica de 1, s, squared 2, s, start superscript, 1, end superscript. O neônio (Ne), por sua vez, tem um total de dez elétrons: dois estão no orbital mais interno 1, s e oito preenchem a segunda camada - dois no orbital 2, s e dois em cada um dos três orbitais p, 1, s, squared 2, s, squared 2, p, start superscript, 6, end superscript.
Como sua camada 2n está preenchida, ele é energeticamente estável como
um átomo único e raramente fará ligações químicas com outros átomos.
A terceira camada eletrônica, 3n, também contém um orbital s e três orbitais p,
e os elementos na terceira linha da tabela periódica colocam seus
elétrons nestes orbitais, assim como os elementos da segunda linha fazem
com a camada 2n. A camada 3n também contém um orbital d, mas este orbital tem energia consideravelmente mais alta que os orbitais 3, s e 3, p
e começa a ser preenchida só a partir da quarta linha da tabela
periódica. Esta é a razão pela qual os elementos da terceira linha, como
o argônio por exemplo, podem ser estáveis com apenas oito elétrons de
valência: suas subcamadas s e p estão preenchidas, embora a camada 3n não esteja inteiramente preenchida.
Enquanto
as camadas e os orbitais eletrônicos estão estreitamente relacionados,
os orbitais fornecem uma imagem mais precisa da configuração eletrônica
de um átomo. Isto porque os orbitais realmente especificam a forma e a
posição das regiões espaciais ocupadas pelos elétrons.

Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.