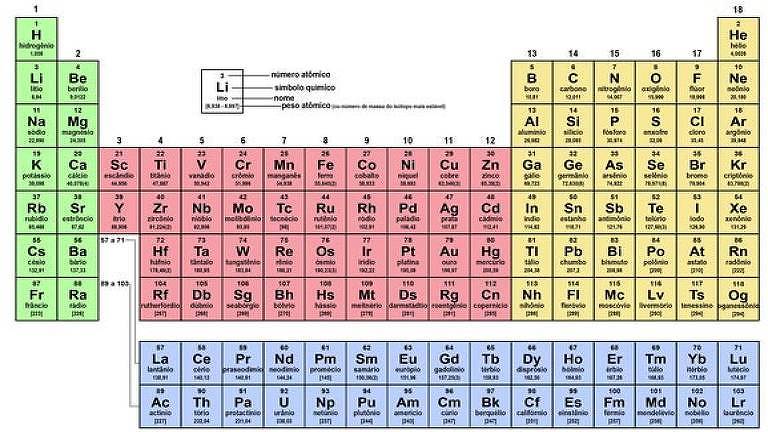
Tabela periódica faz 150 anos.
Em 1869, o químico russo Dmitri Mendeleev apresentou a 1ª versão da tabela, organizando os elementos então conhecidos numa forma bem próxima da atual
Em 1869, o químico russo Dmitri Mendeleev apresentou a 1ª versão da tabela, organizando os elementos então conhecidos numa forma bem próxima da atual

Elementos da tabela periódica do professor Henrique Toma no Institudo de Química da USP Gabriel Cabral/Folhapress
Por: Marcus Cabral
SÃO PAULO
Há 150 anos, quando pouco mais de 60 elementos químicos eram conhecidos, o químico russo Dmitri Mendeleev, professor da Universidade de São Petersburgo, apresentou ao mundo a primeira versão de um dos maiores ícones da ciência moderna: a tabela periódica.
Àquela altura, a alquimia, uma espécie de ancestral mística da química, já havia ficado pra trás, e o conhecimento científico se acumulava rapidamente. Poucos, porém, se dedicavam a sistematizar o que já havia sido descoberto.
No fim do século 18, Lavoisier e outros cientistas já separavam os elementos em grupos como metais e gases, mas ainda se sabia pouco sobre suas propriedades químicas —como os elementos interagem uns com os outros e também a presença de características semelhantes em diferentes elementos.
O que Mendeleev fez foi criar um sistema que, além de catalogar os elementos, permitiu a previsão de propriedades como densidade, reatividade e estabilidade por causa da organização deles, como explica Henrique Toma, professor titular de química da USP, entusiasta de tudo que envolve a tabela periódica e colecionador de elementos químicos, exibidos em um grande mostruário em forma de tabela periódica no Instituto de Química da universidade.
Pela sequência proposta por Mendeleev, os elementos que estão um ao lado do outro na linha horizontal têm propriedades químicas que se repetem de tempos em tempos, a tal periodicidade. E os elementos com características semelhantes ficam na mesma coluna, ou grupo.
Um dos grupos mais famosos é o dos metais alcalinos, o primeiro da tabela e lembrado até por quem saiu da escola faz tempo graças à frase Hoje Li Na Kama Robinson Crusoé em Francês —um jeito de decorar a ordem de lítio, sódio, potássio, rubídio, césio e frâncio. O hidrogênio não é um metal, mas fica logo ali acima e entrou na brincadeira.
Todos os metais alcalinos compartilham características como a formação de sais com os elementos da família dos halogênios e a alta reatividade de suas formas metálicas puras na água, que podem causar intensas explosões graças à formação de gás hidrogênio (H2).
Em 1869, fazia poucas décadas que o sódio (Na), o potássio (K) e o magnésio (Mg) haviam sido isolados em suas formas metálicas pelo britânico Humphry Davy. Para isolar o sódio, ele esquentou e derreteu soda cáustica (NaOH) com o auxílio de uma corrente elétrica, técnica conhecida como eletrólise.
Essa é só uma das maneiras de separar elementos químicos que muitas vezes só aparecem na natureza conjugados a outros átomos, como óxidos, sais e minerais —basicamente, terra e pedras.
Outro jeito de identificar elementos é promover reações com ácidos, capazes de corroer materiais e liberar gases, queimá-los e analisar a cor da chama, além de esquentar, fundir e separar elementos —técnicas aprendidas e refinadas desde a Idade do Bronze, milênios antes de 1869.
O primeiro elemento descoberto por um indivíduo provavelmente foi o fósforo (P), em 1669. O alquimista alemão Hennig Brand processou centenas de litros de urina em uma sucessão de etapas até obter poucos gramas do elemento. Duzentos anos depois, em 1869, já se sabia que carbono, silício e estanho apresentavam algumas propriedades químicas semelhantes, especialmente a forma como se ligam a outros elementos, como o oxigênio e o hidrogênio.
Publicações em revistas especializadas e alguns congressos acadêmicos tentavam dar ordem ao conhecimento que se multiplicava, mas só em 1892 houve um encontro, realizado em Genebra, na Suíça, para lidar com a questão dos nomes dos elementos. A Iupac (União Internacional de Química Pura e Aplicada), responsável por reconhecer as descobertas e aprovar os nomes, só nasceria em 1919.
Visionário, Mendeleev pensava que elementos químicos, unidades formadora de compostos como sais, óxidos e ácidos, poderiam ser categorizados apenas pela massa atômica. Mesmo com conhecimento escasso, previu que alguns deles deveriam ser descobertos com determinados valores de massa —um deles era acertadamente o germânio.
A ideia era boa, mas não estava correta. O que define a maior parte das propriedades químicas de um elemento é a quantidade de prótons no núcleo de um átomo, conhecimento que só veio décadas depois. Mesmo assim, a tabela de Mendeleev, que foi sendo aperfeiçoada ao longo do tempo, já era muito próxima da que temos hoje, com os grupos químicos (colunas) apresentados praticamente da forma como conhecemos.
A partir do urânio (92), os elementos não foram descobertos por reações químicas ou decompondo substâncias por eletrólise, mas, sim, criados em laboratório a partir da colisão entre átomos e entre átomos e partículas subatômicas —as chamadas reações nucleares.
Quem tem especial interesse nessa área são os físicos nucleares, mas são os químicos que estão sempre a postos para batizar e reconhecer elementos.
A desavença entre as sociedades de química (Iupac) e física (Iupap) teve auge no fim de 2015 e no início de 2016, quando a primeira anunciou sozinha o reconhecimento dos elementos 113, 115, 117 e 118, antes mesmo do aval do comitê formado por cientistas também da Iupap.
É também a partir do urânio que os elementos criados começam a ser batizados com nomes inspirados em pessoas ou lugares: férmio (do físico italiano Enrico Fermi), mendelévio (do criador da tabela, Mendeleev), nobélio (do sueco Alfred Nobel, inventor da dinamite e idealizador do prêmio Nobel), rutherfórdio (do físico Ernest Rutherford), seabórgio (o primeiro a homenagear uma pessoa viva, o químico americano Glenn Seaborg), tennessínio (em homenagem ao estado do Tennessee) entre muitos outros.
Todos os elementos a partir do urânio são radioativos, e alguns, especialmente os mais pesados, são particularmente instáveis, decompondo-se em frações de segundo, o que torna muito difícil a identificação e a caracterização físico-química deles.
Mesmo assim, nas últimas décadas, houve grande empenho em completar a sétima linha da tabela, em especial de grupos alemães, russos, americanos e japoneses. O feito se deu com a descoberta do oganessônio (elemento 118), em 2002, e seu reconhecimento formal em 2016.
Agora os físicos nucleares miram nos elementos de número 119 em diante, mas obtê-los não será fácil. A meta é encontrar e caracterizar a chamada ilha de estabilidade desses elementos super pesados, ou seja, a combinação ideal de prótons e nêutrons em cada núcleo a fim de fazer elementos mais duráveis.
Com esse conhecimento, além de um aprendizado importante sobre física quântica, pode ser descoberto algum meio de se obter energia nuclear de forma mais eficiente.
A partir do conhecimento atual, contudo, é difícil até mesmo definir o que seria estabilidade nesses casos —se esses elementos durariam dias, horas ou meros segundos. De todo modo, cientistas já caminham para o número 119 e além.
Apesar de hoje já se saber quase tudo com relação aos elementos químicos, na área de nanomateriais (estruturas com dimensões da ordem de nanômetros, ou milionésimos de milímetro) ainda há muito a ser explorado, diz o químico da USP Henrique Toma.
Esses materiais apresentam propriedades eletrônicas, mecânicas e ópticas (forma como interagem com a luz) bem diferentes dos elementos em suas apresentações usuais. Toma aposta que essa é a próxima fronteira da pesquisa ligada aos elementos químicos.
OS GRUPOS DE CADA COR
Hidrogênio
Diferentemente dos outros componentes da coluna, ele tem a forma de gás. Compõe a maior parte do Universo visível, e é a partir da energia que resta da transformação dele em hélio (He) no Sol que recebemos luz e calor na Terra
Diferentemente dos outros componentes da coluna, ele tem a forma de gás. Compõe a maior parte do Universo visível, e é a partir da energia que resta da transformação dele em hélio (He) no Sol que recebemos luz e calor na Terra
Metais alcalinos
Tirando o hidrogênio, os elementos da primeira coluna —lítio, sódio, potássio, rubídio, césio e frâncio— são os metais alcalinos que, em contato com a água, formam gás hidrogênio, altamente inflamável. São leves, brilhantes e moles
Tirando o hidrogênio, os elementos da primeira coluna —lítio, sódio, potássio, rubídio, césio e frâncio— são os metais alcalinos que, em contato com a água, formam gás hidrogênio, altamente inflamável. São leves, brilhantes e moles
Metais alcalinos terrosos
Nesta família estão berílio, magnésio, cálcio, estrôncio, bário e rádio. Todos ocorrem na natureza. Esses metais tendem a ser prateados e também são relativamente moles e reagem com a água liberando hidrogênio (com exceção do berílio)
Nesta família estão berílio, magnésio, cálcio, estrôncio, bário e rádio. Todos ocorrem na natureza. Esses metais tendem a ser prateados e também são relativamente moles e reagem com a água liberando hidrogênio (com exceção do berílio)
Elementos (ou metais) de transição
O bloco central da tabela tem os famosos ferro, ouro, cobre, platina e titânio. Eles tendem a ser duros e sólidos (a exceção é o mercúrio, líquido à temperatura ambiente); muitos deles fazem parte da indústria siderúrgica
O bloco central da tabela tem os famosos ferro, ouro, cobre, platina e titânio. Eles tendem a ser duros e sólidos (a exceção é o mercúrio, líquido à temperatura ambiente); muitos deles fazem parte da indústria siderúrgica
Terras raras
As duas últimas linhas são dos elementos conhecidos como terras raras. Os actinídios, que abrangem urânio e plutônio, são radioativos. Entre os lantanídios está o neodímio, elemento a partir do qual são feitos poderosos imãs
As duas últimas linhas são dos elementos conhecidos como terras raras. Os actinídios, que abrangem urânio e plutônio, são radioativos. Entre os lantanídios está o neodímio, elemento a partir do qual são feitos poderosos imãs
Metais ordinários
Ocupando um “triângulo” na tabela periódica e com elementos como alumínio, estanho e chumbo, esses metais são moles ou quebradiços e são facilmente fundidos.
Ocupando um “triângulo” na tabela periódica e com elementos como alumínio, estanho e chumbo, esses metais são moles ou quebradiços e são facilmente fundidos.
Metaloides
Elementos dessa “diagonal” estão numa área cinzenta entre os metais e os não metais. Têm aparência metálica, mas não conduzem bem a eletricidade. São quebradiços e hoje são usados em lentes e em semicondutores.
Elementos dessa “diagonal” estão numa área cinzenta entre os metais e os não metais. Têm aparência metálica, mas não conduzem bem a eletricidade. São quebradiços e hoje são usados em lentes e em semicondutores.
Não metais
Carbono, nitrogênio, oxigênio, fósforo, enxofre e selênio—, assim como os das duas colunas seguintes —funcionam como isolantes térmicos e elétricos. Tendem a ser reativos e, desses seis, apenas o oxigênio é gasoso à temperatura ambiente
Carbono, nitrogênio, oxigênio, fósforo, enxofre e selênio—, assim como os das duas colunas seguintes —funcionam como isolantes térmicos e elétricos. Tendem a ser reativos e, desses seis, apenas o oxigênio é gasoso à temperatura ambiente
Halogênios
Flúor, cloro, bromo, iodo e astato também são não metais, mas têm características especialmente reativas e formam sais com outros elementos (como o sódio, que forma o NaCl, o sal de cozinha).
Flúor, cloro, bromo, iodo e astato também são não metais, mas têm características especialmente reativas e formam sais com outros elementos (como o sódio, que forma o NaCl, o sal de cozinha).
Gases nobres
Hélio, neônio, argônio, criptônio, xenônio, radônio —são pouco reativos, o que permite que sejam usados para criar ambientes inertes, que protegem outras substâncias.
Hélio, neônio, argônio, criptônio, xenônio, radônio —são pouco reativos, o que permite que sejam usados para criar ambientes inertes, que protegem outras substâncias.
150 anos da tabela periódica
Conheça cada um de seus 118 elementos
| Nome | Classe | ||
|---|---|---|---|
| Hidrogênio | Não metais | ||
| O hidrogênio, com apenas um próton no núcleo e um elétron, é o átomo mais simples que existe e, curiosamente, é o mais abundante do Universo. O Sol funciona à base da conversão de hidrogênio em hélio | |||
2
He
| Hélio | Gases nobres | |
| Descoberto nas observações do Sol, é o mais leve dos gases nobres —que raramente reagem com outras substâncias e existem por conta própria na natureza, sem formar compostos com outros átomos | |||
| Lítio | Metais alcalinos | ||
| Leve e mole, o lítio é um metal razoavelmente abundante e muito encontrado em baterias de celulares e em outros dispositivos portáteis e até em carros elétricos. Também age no cérebro como um estabilizante de humor | |||
| Berílio | Metais alcalinoterrosos | ||
| Forte e resistente à corrosão, esse metal é usado para fazer janelas em tubos de raios X. Em uma liga com o cobre, que não gera faíscas, é usado para fazer perfurações em poços de petróleo | |||
| Boro | Metaloides | ||
| Sozinho, o boro apresenta-se na forma de um sólido escuro, com grande resistência mecânica e ao calor. Combinado com o nitrogênio (7), forma cristais de nitreto de boro que são usados em máquinas para cortar aço | |||
| Carbono | Não metais | ||
| Apresenta-se em formas tão diferentes quanto o grafite e o diamante, com propriedades físicas bastante distintas. O carbono é o elemento químico que permite a existência das longas moléculas da vida, como o DNA e as proteínas | |||
| Nitrogênio | Não metais | ||
| Abundante na atmosfera em sua forma gasosa (N2), o nitrogênio é captado por bactérias e fungos que o transformam em versões mais aproveitáveis para os demais seres vivos, como a amônia. O nitrogênio é fundamental na formação de moléculas como proteínas e o DNA | |||
| Oxigênio | Não metais | ||
| Crucial para a respiração, o oxigênio também é altamente reativo e participa diretamente da queima de combustíveis e da oxidação de metais | |||
9
F
| Flúor | Halogênios | |
| Em sua forma gasosa (F2), o flúor pode provocar queimaduras severas em contato com o corpo. É tão reativo que pode formar compostos até mesmo com os gases nobres. Na forma iônica, como fluoreto (F-), é usado na água e em produtos de higiene bucal para evitar cáries | |||
10
Ne
| Neônio | Gases nobres | |
| É o menos reativo de todos os elementos. Quando uma corrente elétrica passa por um tubo contendo neônio, é emitida uma luz vermelho-alaranjada que é muito usada em sinais luminosos e letreiros | |||
| Sódio | Metais alcalinos | ||
| Em sua forma metálica, o sódio é altamente reativo. Se uma boa quantidade for jogada em uma massa de água, haverá uma grande explosão graças à formação de gás hidrogênio, altamente inflamável. Ele também forma, com o íon cloreto, o sal de cozinha, mais inofensivo | |||
| Magnésio | Metais alcalinoterrosos | ||
| Altamente inflamável, o pó de magnésio era usado como flash para tirar fotografias antigamente, quando não havia baterias. Em grandes sólidos, ajuda a dissipar o calor em peças de carros de corrida | |||
| Alumínio | Outros metais | ||
| Uma vantagem do alumínio sobre outros metais é que ele não enferruja —em contato com o ar, ele forma uma camada que protege o resto da peça | |||
| Silício | Metaloides | ||
| Apesar de estar no grupo do carbono, o silício não consegue formar longas cadeias moleculares; a substância é usada em eletrônicos por suas habilidades de formar cristais semicondutores (ora conduzindo bem a eletricidade, ora funcionando como isolantes) | |||
| Fósforo | Não metais | ||
| Um das formas como aparece na natureza é o fósforo branco: tóxico e capaz de pegar fogo espontaneamente, ele é usado em bombas. O fósforo vermelho, menos perigoso, aparece nas caixas de fósforos de segurança, de uso doméstico | |||
| Enxofre | Não metais | ||
| Fedido e de coloração amarelada, o enxofre é usado na fabricação da pólvora e para ajustar a acidez do solo; também é muito usado pela indústria na forma de ácido sulfúrico | |||
17
Cl
| Cloro | Halogênios | |
| De cor amarelo-pálida, o cloro já foi usado como gás venenoso na 1ª Guerra Mundial; em pequenas quantidades, funciona como um eficiente desinfetante | |||
18
Ar
| Argônio | Gases nobres | |
| Normalmente transparente, quando é excitado por uma corrente elétrica, esse gás nobre exibe uma coloração azulada. Permanece inerte mesmo em altas temperaturas | |||
| Potássio | Metais alcalinos | ||
| Em sua forma metálica, é bastante reativo; na forma de íon, K+, participa de vários processos do organismo, como na transmissão de impulsos nervosos e do funcionamento dos rins | |||
| Cálcio | Metais alcalinoterrosos | ||
| A forma metálica do cálcio é muito instável e é mais fácil vê-lo na forma de rochas calcárias; na forma iônica, Ca2+ , participa de diversos processo bioquímicos, como a contração muscular | |||
| Escândio | Metais de transição | ||
| É um metal usado em ligas metálicas resistentes com alumínio para fazer de bicicletas a aviões de caça. O iodeto de escândio ajuda a produzir uma luz branca suave, semelhante à coloração do Sol | |||
| Titânio | Metais de transição | ||
| Por não enferrujar nem causar alergias, o metal é usado em implantes e próteses; seu preço é elevado não pela raridade, mas pela dificuldade em processar o minério. O dióxido de titânio é o pigmento usado em tintas brancas | |||
| Vanádio | Metais de transição | ||
| O vanádio é usado em ligas de aço e aparece em diversas ferramentas de uso doméstico; sua dureza permite a confecção de brocas, chaves e alicates, por exemplo | |||
| Cromo | Metais de transição | ||
| Geralmente forma finíssimas superfícies que recobrem estruturas metálicas, dando aspecto claro e brilhante; a liga de aço inoxidável é composta de cerca de 20% de crômio | |||
| Manganês | Metais de transição | ||
| O manganês é muito utilizado em ligas com o ferro e, como outros metais em forma iônica, tem grande valia biológica ao ser utilizado em processos enzimáticos realizados pelo organismo | |||
| Ferro | Metais de transição | ||
| O ferro enferruja, mas isso não impede que tenha inúmeras aplicações: ele é facilmente soldado, fundido, trabalhado a frio, endurecido, anelado e moldado; se não bastasse, ele ainda está nos núcleos das moléculas de hemoglobina, que permitem a respiração em diversos animais | |||
| Cobalto | Metais de transição | ||
| A liga conhecida como aço de cobalto é usada para fazer brocas e discos de moagem para máquinas de trituração | |||
| Níquel | Metais de transição | ||
| O níquel é muito usado para proteger objetos de ferro contra a ferrugem. A liga níquel-ferro possui alta resistência ao calor e é usada em motores à jato | |||
| Cobre | Metais de transição | ||
| O cobre é mole o suficiente para ser trabalhado em materiais elétricos e duro o bastante para fazer ligas metálicas com o estanho —bronze— ou com o zinco —latão; é um dos poucos elementos metálicos que não são acinzentados | |||
| Zinco | Metais de transição | ||
| O zinco é usado para proteger tanques de aço, trilhos e cascos de navios contra a ferrugem, já que ele se oxida mais facilmente e conserva as demais estruturas | |||
| Gálio | Outros metais | ||
| O ponto de fusão do gálio é baixo (pouco menos de 30°C), o que dá a ele um uso inusitado: junto com o índio (49) e o estanho (50), eles formam uma liga, a galinstan, que substitui o mercúrio em termômetros | |||
| Germânio | Metaloides | ||
| O germânio foi um dos elementos previstos pelo russo Dimitri Mendeleev quando ele sistematizou a tabela periódica; depois que ele foi descoberto, foi constatado que ele tinha as propriedades imaginadas pelo químico. O semicondutor foi útil para fazer transístores quando não havia silício de alta pureza | |||
| Arsênio | Metaloides | ||
| Trata-se de um nutriente importante para alguns animais como galinhas, ratos, cabras e outras espécies; uma dose alta, porém, é letal —para humanos, inclusive. Não se sabe se o arsênio tem um papel importante no nosso organismo | |||
| Selênio | Não metais | ||
| É um nutriente essencial para humanos, mas pode ser tóxico em altas quantidades —vale tomar cuidado ao comer castanhas-do-Pará, ricas nesse elemento. Impressoras à laser contêm um cilindro coberto com selênio, que, quando é exposto à luz, age como condutor, permitindo a impressão só nas áreas de interesse | |||
35
Br
| Bromo | Halogênios | |
| O bromo, um poderoso desinfetante, é um dos dois elementos que, em sua forma pura, é líquido na temperatura ambiente (o outro é o mercúrio). Torna-se um gás muito facilmente, entrando em ebulição a apenas 59°C | |||
36
Kr
| Kriptônio | Gases nobres | |
| O alto peso molecular desse gás nobre permite que ele seja usado para proteger filamentos de tungstênio em lâmpadas, que chegam a altas temperaturas; quando atravessado por uma corrente elétrica, o kriptônio emite uma luz branco-azulada | |||
| Rubídio | Metais alcalinos | ||
| Quando queimado, o metal rubídio tem coloração avermelhada —daí seu nome, que não tem a ver com a pedra preciosa. Na forma de vapor, pode ser usado como relógio atômico, assim como o césio (elemento 55) | |||
| Estrôncio | Metais alcalinoterrosos | ||
| Pode ser usado em ligas metálicas como a de alumínio-silício para adicionar resistência; também está presente em pinturas luminescentes | |||
| Ítrio | Metais de transição | ||
| O ítrio é usado para aumentar a vida em velas de ignição de automóveis. O óxido de cobre, bário e ítrio (conhecido como YBCO), quando resfriado com nitrogênio se transforma num supercondutor. Já o óxido de alumínio e ítrio (YAG) é usado para fazer lasers | |||
| Zircônio | Metais de transição | ||
| É resistente o suficiente para conter pastilhas de combustível em reatores nucleares. O óxido de zircônio em sua forma cristalina é a melhor imitação de diamante já produzida | |||
| Nióbio | Metais de transição | ||
| O nariz dos foguetes é feito de liga de nióbio porque ela resiste à corrosão mesmo sob altas temperaturas. Junto com o titânio, cria intensos campos magnéticos em máquinas de ressonância magnética | |||
| Molibdénio | Metais de transição | ||
| Apesar de ser um metal resistente, oxida-se rapidamente quando aquecido a mais de 500°C; já na forma de dissulfeto de molibdênio, é um excelente lubrificante, resistindo à alta temperatura e à alta pressão | |||
| Tecnécio | Metais de transição | ||
| Bem no meio da faixa estável da tabela periódica está o tecnécio, radioativo e feito pelo homem (embora possa raramente ocorrer na natureza). Ele pode ser usado na medicina para detectar o crescimento de tumores ósseos, por meio da emissão de radiação | |||
| Rutênio | Metais de transição | ||
| Metal precioso, é usado em joias para dar um acabamento escuro, muitas vezes banhando objetos formados por outros metais mais baratos. É bastante resistente à corrosão | |||
| Ródio | Metais de transição | ||
| Possui um alto brilho e um preço bastante elevado, comparável (e até mesmo superior) ao da platina e do ouro. É usado em joias e para dar brilho em bijuterias | |||
| Paládio | Metais de transição | ||
| O paládio pode formar finíssimas folhas, como se fossem teias de aranha, que atuam como catalisadores em veículos e permitem a conversão de moléculas poluentes em outras inócuas | |||
| Prata | Metais de transição | ||
| A prata é o metal que melhor reflete a luz e o que melhor conduz a eletricidade. A desvantagem é que, com o tempo, escurece em contato com o ar e perde essas propriedades | |||
| Cádmio | Metais de transição | ||
| O cádmio, antes muito usado em baterias, vem sendo substituído pelos íons de lítio nessa função. O metal, assim como o mercúrio (80) e o chumbo (82), pode, cronicamente, provocar intoxicações graves em seres vivos. O sulfeto de cádmio é um pigmento amarelo bastante vivo | |||
| Índio | Outros metais | ||
| Na forma de óxido de índio e estanho (ITO) é usado em telas de LCD, por ser transparente e conduzir eletricidade | |||
| Estanho | Outros metais | ||
| Metal barato e fácil de fundir e moldar —por isso, usado em ligas de solda, como a de chumbo-estanho; também é achado em latas de alimentos | |||
| Antimônio | Metaloides | ||
| Esse metaloide é muito usado em ligas de chumbo para acrescentar dureza ao material, seja em tipos para a impressão (como na imprensa de Gutenberg) ou na fabricação de projéteis para armas de fogo | |||
| Telúrio | Metaloides | ||
| Já teve aplicação importante na composição de CDs e DVDs regraváveis —a refletividade da camada de subóxido de telúrio era alterada com o aquecimento por laser | |||
53
I
| Iodo | Halogênios | |
| Na temperatura ambiente é um sólido marrom, com aplicações nas medicinas humana e veterinária no tratamento de feridas; também é um nutriente importante e presente na forma de íons no sal de cozinha | |||
54
Xe
| Xenônio | Gases nobres | |
| É o mais caro dos gases nobres. Lâmpadas de xenônio podem operar a altas temperaturas e gerar alto brilho, seja nos faróis de carros ou em projetores de cinema | |||
| Césio | Metais alcalinos | ||
| O césio é muito reativo, mas sua aplicação mais notória não é causar explosões, e sim servir de relógio: se preservado de interferências magnéticas e elétricas, pode ser tão preciso que somente a cada 70 milhões de ano um relógio à base do material se atrasaria em 1 segundo | |||
| Bário | Metais alcalinoterrosos | ||
| O elemento, na forma de sulfato de bário, é usado para permitir exames de imagem do trato gastrointestinal. Por reagir rapidamente com oxigênio, esse metal é usado para “limpar” alguns ambientes da presença do gás | |||
57
La
| Lantânio | Lantanídeos | |
| É o primeiro dos lantanídios, uma das terras raras (que não são raras, na verdade) mais abundantes | |||
58
Ce
| Cério | Lantanídeos | |
| Incendeia-se com facilidade, o que permite seu uso no cinema. O pó de cério pode ser usado para moer vidro | |||
59
Pr
| Praseodímio | Lantanídeos | |
| Pode ser usado em lentes de óculos que absorvem a luz amarela, permitindo que se enxergue melhor o vidro incandescente por especialistas no manuseio do material (hialotécnicos) | |||
60
Nd
| Neodímio | Lantanídeos | |
| Talvez o mais famoso elemento do grupo das terras raras, o neodímio forma uma liga com ferro e com o boro que é, com larga vantagem, o ímã mais forte disponível, com aplicações em motores e em fones de ouvido | |||
61
Pm
| Promécio | Lantanídeos | |
| Além do tecnécio (43), o promécio é o outro elemento instável que antecede o bismuto (83); já foi usado em lâmpadas fluorescentes e em tintas luminescentes | |||
62
Sm
| Samário | Lantanídeos | |
| Os ímãs formados por samário-cobalto, diferentemente daqueles de neodímio-ferro-boro, resistem a altas temperaturas e são empregados em guitarras elétricas | |||
63
Eu
| Európio | Lantanídeos | |
| É usado em tintas luminescentes que podem emitir luz por vários minutos ou, de modo mais discreto, por diversas horas; era usado nos antigos monitores de tubo para dar uma cor vermelho-brilhante | |||
64
Gd
| Gadolínio | Lantanídeos | |
| O contraste de gadolínio pode ser usado na medicina para encontrar cistos cerebrais em exames de ressonância magnética | |||
65
Tb
| Térbio | Lantanídeos | |
| O térbio e o terfenol, uma liga produzida a partir dele, mudam de forma quando submetidos a um campo magnético e são capazes de crescer, com aplicações em sonares e em outros dispositivos eletrônicos | |||
66
Dy
| Disprósio | Lantanídeos | |
| Sais de iodeto de disprósio são usados para emitir luz vermelha e também na confecção de lasers, em conjunto com o vanádio (V) | |||
67
Ho
| Hólmio | Lantanídeos | |
| Esse metal pode ser usado como uma espécie de capa para aumentar a intensidade de ímãs, como em máquinas de ressonância magnética | |||
68
Er
| Érbio | Lantanídeos | |
| É usado para intensificar os pulsos de luz em cabos de fibra óptica, alimentado por um laser | |||
69
Tm
| Túlio | Lantanídeos | |
| Contribui para melhorar a faixa de emissão de verde em algumas lâmpadas | |||
70
Yb
| Itérbio | Lantanídeos | |
| É usado como “agente dopante”, ou seja, como uma impureza capaz de alterar as propriedades de um sistema --no caso, de lasers, armazenando energia para intensificar a luz emitida | |||
71
Lu
| Lutécio | Lantanídeos | |
| O brometo de lutécio pode ser usado em tubos de descarga de alta intensidade elétrica para gerar luz | |||
| Háfnio | Metais de transição | ||
| O metal é extremamente resistente à corrosão, mesmo em altas temperaturas. Hoje é empregado em cabeçotes de maçaricos de plasma capazes de cortar o aço com um jato de ar quente | |||
| Tântalo | Metais de transição | ||
| Empregado em capacitores em circuitos eletrônicos e digitais, o metal já foi usado em filamentos de lâmpadas incandescente, antes de o tungstênio assumir a função | |||
| Tungstênio | Metais de transição | ||
| Resistente a altas temperaturas e barato, o tungstênio foi muito usado na lâmpada incandescentes, mas tem outras funções: por ser denso, pode ser usado na indústria de armas para elaborar projéteis. O carbeto de tungstênio é muito usado para cortar metais | |||
| Rênio | Metais de transição | ||
| É geralmente utilizado em ligas de níquel-ferro nas turbinas de motores a jato em aviões de combate | |||
| Ósmio | Metais de transição | ||
| Um dos elementos mais densos, o ósmio, na liga com o irídio, é usado em agulhas de vitrolas e em ponta de canetas tinteiros graças à sua durabilidade; o tetróxido de ósmio é usado para ajudar a enxergar estruturas subcelulares na microscopia eletrônica | |||
| Irídio | Metais de transição | ||
| Por seu alto custo, o irídio raramente tem aplicações na indústria. Pode ser usado em velas de veículos de alto custo, a fim de que elas durem por mais de 150 mil km | |||
| Platina | Metais de transição | ||
| Apesar de ser altamente resistente à corrosão, a platina é mais utilizada como catalisador de reações e processos químicos --na obtenção de gasolina a partir do petróleo e nos conversores de escapamentos, por exemplo, tornando veículos menos poluentes. Por muito tempo, o peso de um quilograma foi definido por um cilindro de platina (com 10% de irídio) armazenado em Paris | |||
| Ouro | Metais de transição | ||
| A pouca disponibilidade do ouro no mundo explica seu preço elevado —tudo o que já foi minerado caberia em três piscinas olímpicas. Por não oxidar, ele mantém seu brilho eternamente, o que o torna muito útil em contatos elétricos | |||
| Mercúrio | Metais de transição | ||
| O único metal em forma líquida à temperatura ambiente é o mercúrio, que desperta fascínio desde a antiguidade; misturado com prata e zinco, forma uma amálgama que já foi muito utilizada em restaurações odontológicas. O mercúrio também é utilizado na mineração do ouro e pode formar compostos perigosos para a saúde que se acumulam no organismo | |||
| Tálio | Outros metais | ||
| Diferentemente do envenenamento por arsênio (33), aquele por tálio ainda é relativamente pouco conhecido. Os sintomas incluem vômito, perda de cabelo, delírio, cegueira e dor abdominal | |||
| Chumbo | Outros metais | ||
| O metal é muito usado em projéteis por sua maleabilidade (não fica entalado no cano da arma) e densidade. É um importante contaminante do ambiente | |||
| Bismuto | Outros metais | ||
| O bismuto é o último elemento estável da tabela periódica. Na verdade sua meia-vida, o tempo necessário para desintegração da metade de uma massa da substância, é um bilhão de vezes maior que a idade do Universo —ou seja, ele é estável o suficiente. O bismuto aparece no subsalicilato de bismuto, remédio conhecido para o alívio estomacal | |||
| Polônio | Outros metais | ||
| Descoberto por Marie Curie, ocorre naturalmente em minérios de urânio (92); o contato com uma pequena quantidade pode matar | |||
85
At
| Ástato | Halogênios | |
| Com meia-vida de apenas 8,3h o astato ocorre naturalmente, assim como todos elementos até o urânio (92). No entanto, dificilmente haverá uma amostra grande o suficiente para ser analisada —rapidamente ali haverá um outro elemento químico, e não mais astato. O elemento poderia ser usado para combater tumores em tratamentos de radioterapia, mas é muito difícil de sintetizar e seu manuseio também é difícil | |||
86
Rn
| Radônio | Gases nobres | |
| O radônio é um gás nobre radioativo, com meia-vida de 3,2 dias. Ele se forma naturalmente a partir do decaimento do urânio (92) e do tório (90), presentes em grandes quantidades nos leitos de granito; a formação desse gás pode gerar instabilidade estrutural em edificações | |||
| Frâncio | Metais alcalinos | ||
| É o menos estável dos elementos naturais, com meia-vida de apenas 22 minutos; ainda não foram encontradas aplicações para essa radioatividade | |||
| Rádio | Metais alcalinoterrosos | ||
| Foi muito usado no passado, quando se acreditava que a radioatividade faria bem à saúde (algumas pessoas ainda acreditam); muitas mulhereres que pintaram com tinta à base de rádio os números e ponteiros de relógios morreram pela exposição excessiva à radiação | |||
89
Ac
| Actínio | Actinídios | |
| Todos os elementos da série dos actinídios são radioativos. Com meia-vida de 21,8 anos, o actínio luminesce por si só e é encontrado em minérios de urânio (92) | |||
90
Th
| Tório | Actinídios | |
| Foi usado em lanternas, em bebidas supostamente fortificantes e até em pasta de dente. É um metal bastante abundante, tanto que os cientistas tentaram fazer reatores nucleares para usar tório em vez de urânio, sem sucesso | |||
91
Pa
| Protactínio | Actinídios | |
| A meia-vida do protactínio é de 32.788 anos, o que daria tempo o suficiente para ele ser observado, mas não há muito dele disponível por aí. Graças a sua escassez e toxicidade, não há aplicações para o elemento além da pesquisa científica | |||
92
U
| Urânio | Actinídios | |
| Apenas 0,71% do urânio do planeta é do tipo urânio-235 (com 92 prótons e 143 nêutrons); 99,28% é do tipo urânio-238 (com 92 prótons e 146 nêutrons). O utilizado para a bomba atômica é justamente o tipo mais raro; o metal radioativo já foi usado na fabricação de itens de cozinha do passado | |||
93
Np
| Neptúnio | Actinídios | |
| O neptúnio é o primeiro dos chamados elementos transurânicos e foi descoberto em 1940 na Universidade da Califórnia, em Berkeley. Via de regra, o urânio é considerado o último elemento natural, mas pode ser que traços de neptúnio ocorram junto do elemento 92 | |||
94
Pu
| Plutônio | Actinídios | |
| É difícil fazer uma bomba atômica de plutônio, como aquela lançada sobre Nagasaki, no Japão. Há o risco de haver um “chiado” e a reação ser imperfeita e inefetiva, com pouco poder de destruição | |||
95
Am
| Amerício | Actinídios | |
| O amerício é utilizado em detectores de fumaça —quando há sinal dela, o fluxo de radiação é interrompido, acionando o dispositivo | |||
96
Cm
| Cúrio | Actinídios | |
| Foi descoberto em 1944 com o uso de um acelerador de partícula em Berkeley pela equipe de Glenn Seaborg, físico nuclear americano que participou da descoberta de uma série de elementos transurânicos. Átomos de cúrio são potentes lançadores de partículas alfa (equivalentes ao núcleo do átomo de hélio) | |||
97
Bk
| Berquélio | Actinídios | |
| Sua meia-vida é de 1.379 anos para o isótopo mais estável, o berkélio-247. Seu decaimento radioativo pode formar uma série de elementos, até finalmente chegar no chumbo, que é estável | |||
98
Cf
| Califórnio | Actinídios | |
| É um poderoso emissor de nêutrons, partículas que, ao atingir outras, podem provocar reações em cadeia que permitem investigar a presença de outros elementos em uma amostra | |||
99
Es
| Einsténio | Actinídios | |
| O isótopo mais comum, o einstênio-253, tem meia-vida aproximada de 20,47 dias. A descoberta foi feita a partir da análise de dados da explosão de uma bomba de hidrogênio em 1952. O einstênio, cujo nome foi dado em homenagem ao físico Albert Einstein, foi identificado por seu padrão de decaimento radioativo, como outros elementos transurânicos | |||
100
Fm
| Férmio | Actinídios | |
| Também descoberto a partir de dados da explosão da bomba de hidrogênio, em 1952, o elemento 100, assim como o 99, foi somente apresentado ao mundo em 1955, depois de ambos terem sido observados por outros métodos | |||
101
Md
| Mendelévio | Actinídios | |
| O mendelévio (em homenagem ao criador da tabela periódica) foi obtido ao bombardear átomos de einstênio com partículas alfa. Foi produzido o mendelévio-256, com meia-vida de apenas 77 minutos. Isso também ocorreu em 1955, por Seaborg e cia. | |||
102
No
| Nobélio | Actinídios | |
| Com outros elementos vizinhos, foi descoberto por Seaborg e companhia. É aparentemente uma versão mais pesada do itérbio, com meia vida de alguns minutos para os isótopos mais estáveis; o nome foi dado em homenagem ao sueco Alfred Nobel, inventor da dinamite e idealizador do prêmio Nobel | |||
103
Lr
| Laurêncio | Actinídios | |
| O nome vem de Ernest Lawrence, inventor do cíclotron, equipamento que permite o manuseio de partículas com campos elétricos, a fim de criar colisões —o que permitiu a descoberta de novas partículas | |||
| Rutherfórdio | Metais de transição | ||
| O isótopo mais longevo tem meia-vida de 1,3 horas e seu nome é uma homenagem ao físico Ernest Rutherford. Ele se comporta de forma parecida com o háfinio. O crédito por sua descoberta foi disputado por americanos e soviéticos; em 1997, o mérito da descoberta foi dividido entre os grupos | |||
| Dúbnio | Metais de transição | ||
| A pesquisa de elementos como o dúbnio é difícil por causa de seu rápido decaimento radioativo. O nome homenageia a cidade russa de Dubna, que abriga um importante centro de pesquisa em física de partículas | |||
| Seabórgio | Metais de transição | ||
| Produzido pela primeira vez na década de 1970, foi o primeiro elemento a homenagear uma pessoa viva (o segundo é o oganessônio, elemento 118). Seaborg participou diretamente da descoberta de 10 elementos e mais de 100 isótopos | |||
| Bóhrio | Metais de transição | ||
| O nome é uma homenagem ao cientista dinamarquês Niels Bohr, que ajudou a entender a estrutura dos átomos no começo do século 20. Seu isótopo mais estável, o bóhrio-270, tem meia-vida de 61 segundos | |||
| Hássio | Metais de transição | ||
| A meia-vida do hássio —uma homenagem ao estado alemão de Hesse— é de 10 segundos. O maior crédito da descoberta foi dado ao instituto alemão GSI, localizado na cidade de Darmstadt | |||
| Meitnério | Metais de transição | ||
| A física Lise Meitner foi uma das maiores descobridoras da fissão nuclear, e o elemento 109 é uma homenagem a ela. Esse elemento também foi descoberto no GSI no começo da década de 1980 | |||
| Darmstácio | Metais de transição | ||
| Extremamente radioativo, sua meia-vida é de aproximadamente 10 segundos. Foi criado pela primeira vez em 1994 também pelo GSI a partir da fusão de átomos de chumbo (82) com níquel (28) | |||
| Roentgênio | Metais de transição | ||
| Outra das descobertas do instituto alemão GSI. Cientistas bombardearam bismuto (83) com um núcleo de níquel (28). O mesmo procedimento foi feito antes por cientistas soviéticos, mas não houve detecção. A meia-vida do roentgênio chega a 10,7 minutos | |||
| Copernício | Metais de transição | ||
| Mais uma criação do GSI, realizada pela primeira vez em 1996, combinando átomos de chumbo com zinco dentro de um acelerador de partículas. Seu isótopo mais estável, o corpernício-285, tem meia-vida de 28 segundos | |||
| Nipônio | Outros metais | ||
| Na disputa pela criação dos últimos elementos da tabela estavam grupos de todo o mundo. O JINR, Instituto Conjunto para Pesquisa Nuclear, na Rússia, afirmou ter achado o elemento 113 em 2003, e os japoneses do instituto Riken, em 2004, mas os asiáticos demonstraram o feito de forma mais convincente e puderam dar nome ao elemento | |||
| Fleróvio | Outros metais | ||
| O elemento foi batizado em homenagem ao laboratório Flerov, localizado no JINR, em Dubna, na Rússia, em 1998. O nome só foi adotado pela Iupac (união de entidades de química) em 2012 | |||
| Moscóvio | Outros metais | ||
| Seu isótopo mais duradouro, o moscóvio-290, tem meia-vida de apenas 650 milissegundos. A descoberta foi feita no JINR, em uma colaboração russo-americana, em 2003. A descoberta foi reconhecida em 2015 pela Iupac | |||
| Livermório | Outros metais | ||
| A homenagem é para o Laboratório Nacional Lawrence Livermore, nos EUA, que colaborou com o JINR para realizar a descoberta no começo deste século. Seu isótopo mais estável, o livermório-293, tem meia-vida de apenas 57 milissegundos | |||
| Tenesso | Outros metais | ||
| Uma homenagem ao estado americano do Tennessee. O nome veio da sugestão da colaboração russo-americana que conseguiu desvendar boa parte do final do sétimo período da tabela periódica | |||
118
Og
| Oganésson | Gases nobres | |
| O último elemento conhecido da tabela periódica seria um gás nobre, mas não deu tempo de verificar: sua meia vida é de menos de 1 milissegundo. Ele foi encontrado ao bombardear átomos de califórnio (98) com cálcio (20). O nome é uma homenagem ao russo Yuri Oganessian (1933-), que comandou diversas descobertas ligadas aos elementos superpesados. | |||









Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.