Como funciona o CRISPR?
CRISPR, abreviação de CRISPR-Cas9, é uma ferramenta de edição de genoma que permite aos cientistas cortar e modificar com precisão sequências de DNA. Revolucionou o estudo dos genes, ajudou a melhorar as colheitas e melhorou os cuidados de saúde.
O sistema de edição de genes foi originalmente descoberto em bactérias , onde limita as infecções cortando o DNA viral. Depois, num trabalho vencedor do prémio Nobel , este aparelho de defesa bacteriana foi cooptado pelos cientistas para conceber uma nova abordagem à edição do genoma.
“É realmente a simplicidade, o custo e a facilidade de uso” que democratizaram esta ferramenta de edição, disse Alison Van Eenennaam , geneticista pecuária da Universidade da Califórnia, Davis, que usa CRISPR para alterar a genética dos animais de fazenda, ao WordsSideKick.com.
Recentemente, o CRISPR foi aprovado para tratar duas doenças sanguíneas, e ensaios em fase inicial revelam o seu potencial para tratar a cegueira hereditária. Aqui está tudo o que você precisa saber sobre a tecnologia inovadora.
What is CRISPR?
The CRISPR system includes the following major components:
CRISPR: "CRISPR" stands for "clusters of regularly interspaced short palindromic repeats." This unwieldy name describes a pattern of DNA sequences found in bacterial genomes that helps the bacteria fend off viruses.
"Repetições palindrômicas curtas" referem-se a sequências que são lidas da mesma forma para frente e para trás, como as palavras "caiaque" e "carro de corrida". O DNA consiste em duas fitas pares torcidas uma em torno da outra em uma hélice. Um palíndromo de DNA, portanto, refere-se a uma sequência de letras de DNA, ou bases - A (adenina), C (citosina), G guanina) e T (timina) - que são iguais quando lidas para frente em uma fita e lidas de trás para frente na outra. .
Por exemplo, se uma fita ler "GATC" em uma direção, essas bases de DNA formarão pares com "CTAG" na fita oposta porque G sempre emparelha com C e A sempre emparelha com T. Quando lido de trás para frente, CTAG se torna a sequência original , GATC.
Essas repetições são “regularmente interespaçadas”, o que significa que essas regiões CRISPR no genoma contêm um padrão alternado de palíndromos com sequências “espaçadoras” encaixadas entre elas. As bactérias cooptam as sequências espaçadoras do DNA dos vírus invasores e as armazenam em suas regiões CRISPR para combater futuras infecções.
Este sistema é frequentemente comparado ao sistema imunológico adaptativo humano , que armazena de forma semelhante uma “memória” de infecções anteriores para evitar encontros repetidos. Em vez de usar células imunológicas , como fazem os humanos, as bactérias usam CRISPR.
RNA CRISPR (crRNA) e Cas9: O DNA CRISPR serve como um registro permanente de infecções passadas, mas para que as bactérias usem essas sequências para impedir vírus, elas devem convertê-las no primo do DNA, o RNA . Através de um processo denominado transcrição, as bactérias primeiro copiam uma das duas cadeias de DNA CRISPR em uma única cadeia complementar de RNA; a fita é complementar porque corresponde ao código original do DNA, exceto que substitui T por U (uracila). Em seguida, os micróbios cortam a cadeia longa em fragmentos mais curtos de crRNA, cada um carregando uma repetição e um espaçador.
A bactéria também produz uma segunda molécula de RNA, chamada “ crRNA transativador ” ou tracrRNA. Este RNA contém uma versão invertida da repetição palindrômica na molécula de crRNA, permitindo que os dois RNAs se liguem.
O complexo resultante pode então fixar-se no ADN viral que transporta a sequência espaçadora, invocando uma enzima que corta e desactiva esse ADN. A enzima, chamada “proteína 9 associada ao CRISPR”, ou Cas9, é essencialmente uma tesoura molecular.
Existem também outros tipos de enzimas Cas que podem ser utilizadas na edição de genes. Por exemplo, um chamado Cas12a produz cortes escalonados no DNA, nos quais uma fita é mais longa que a outra em cada extremidade. As sequências de DNA podem então ser emparelhadas com a fita saliente. Cas14 faz cortes no RNA , em vez de no DNA, e pode ser útil para alterar temporariamente as proteínas que uma célula produz sem fazer edições permanentes em seu genoma.
Relacionado: Conheça ‘Fanzor’, o primeiro sistema semelhante ao CRISPR encontrado em vidas complexas 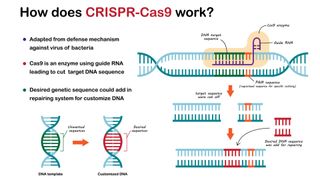
Como o CRISPR edita o DNA?
Os pesquisadores aproveitaram a capacidade do sistema CRISPR de fazer cortes precisos no DNA. Ao adaptar o CRISPR para fazer edições desejáveis no genoma de qualquer tipo de célula, os investigadores podem alterar genes ou sequências de ADN que regulam a atividade dos genes, alterando a sua função ou expressão.
Para simplificar o sistema, os cientistas combinaram as moléculas de crRNA e tracrRNA descritas na seção anterior em uma única molécula chamada “RNA guia”.
“Tudo o que você precisa fazer para atingir uma nova sequência é alterar o guia”, disse Van Eenennaam, o que é barato e rápido de fazer. Em contraste, outras técnicas de edição de genoma requerem o projeto demorado e caro de uma proteína produzida em laboratório que tenha como alvo uma sequência de interesse.
O RNA guia é emparelhado com uma enzima Cas9 para fazer edições no genoma. Uma vez que o RNA se liga à sequência desejada, a enzima avança e corta ambas as fitas de DNA. Em resposta, a célula tenta colar os fios novamente, mas usa um processo cheio de falhas que muitas vezes introduz mutações. Por exemplo, pode adicionar algumas letras extras. Esta mudança muitas vezes desativa o gene, tornando a edição CRISPR uma estratégia simples para desligar genes.
Os cientistas também modificaram a enzima Cas9 para fazer outros tipos de edições. Ao desativar a tesoura genética do Cas9 e depois fundir esse “Cas9 morto” com outra enzima, eles podem equipar o maquinário para alterar bases únicas , convertendo um C em um T, por exemplo. Esta formulação CRISPR é chamada de “ edição de base ” e permite aos pesquisadores fazer pequenas mudanças que alteram a estrutura do produto codificado pelo gene, seja ele uma proteína ou RNA.
Dead Cas9 também foi combinado com enzimas que ativam ou silenciam genes para ajustar sua atividade. Dead Cas9 também foi fundido com proteínas fluorescentes , que acendem quando o RNA guia se liga a um trecho específico de DNA, revelando essencialmente seu código postal na célula.
Relacionado: Algum dia o CRISPR poderá curar o HIV?
Quem descobriu o CRISPR?
A história do CRISPR remonta a 1987, quando Yoshizumi Ishino e colegas da Universidade de Osaka, no Japão, relataram pela primeira vez as sequências invulgarmente repetitivas em Escherichia coli , uma bactéria bem conhecida. Na época, os cientistas não sabiam como esses aglomerados estavam relacionados com a defesa bacteriana.
Na década de 1990, estes aglomerados chamaram a atenção de mais cientistas quando Francisco Mojica (que cunhou o termo "CRISPR" ) e a sua equipa da Universidade de Alicante, em Espanha, os detectaram em outros 20 genomas bacterianos , sugerindo que tinham uma importância generalizada nas bactérias.
Em 2005, Alexander Bolotin e colegas do Instituto Nacional Francês de Pesquisa Agrícola encontraram genes para enzimas Cas localizadas perto da região CRISPR de um genoma. Pouco depois, o grupo de Eugene Koonin nos Institutos Nacionais de Saúde revelou que as sequências espaçadoras correspondiam ao ADN viral , levando os investigadores a associar o CRISPR à imunidade bacteriana.
Emmanuelle Charpentier , do Instituto Max Planck, na Alemanha, e Jennifer Doudna , da Universidade da Califórnia, Berkeley, adaptaram posteriormente o CRISPR para edição do genoma. O seu trabalho levou-os a partilhar o Prémio Nobel da Química de 2020 .
Pouco depois da publicação inovadora do trabalho de Charpentier e Doudna, Virginijus Šikšnys
do Instituto Universitário de Biotecnologia de Vilnius e seus colegas
também demonstraram como o CRISPR poderia ser usado na edição genética. O grupo de Feng Zhang no Broad Institute desenvolveu posteriormente outros sistemas CRISPR em ferramentas de edição de genes, incluindo um sistema de edição de RNA envolvendo uma enzima chamada Cas13 .
How has CRISPR been used in people? What about in plants and animals?
O CRISPR tem sido usado para corrigir doenças genéticas, como fibrose cística e catarata , em células cultivadas em laboratório e em animais de laboratório. Também demonstrou sucesso recente como tratamento para outras condições em testes em humanos. Notavelmente, o Reino Unido e os EUA aprovaram uma terapia genética baseada em CRISPR chamada Casgevy para duas doenças do sangue: doença falciforme e talassemia beta. Esta é a primeira terapia baseada em CRISPR a ser aprovada.
Casgevy atua cortando e desativando o gene BCL11A , que controla a mudança da hemoglobina fetal para a hemoglobina adulta logo após o nascimento.
A versão fetal se liga mais fortemente ao oxigênio , permitindo que o feto obtenha oxigênio suficiente da corrente sanguínea da mãe. A versão adulta normalmente assume o controle após o nascimento, uma vez que o oxigênio pode ser obtido através da respiração. No entanto, na doença falciforme e na talassemia beta, as pessoas apresentam versões defeituosas do gene adulto. Casgevy reverte a mudança para a hemoglobina adulta para que os pacientes possam continuar usando o gene da hemoglobina fetal.
Uma forma de cegueira hereditária pode estar entre os próximos distúrbios tratados com CRISPR. Um ensaio em estágio inicial testou a injeção de componentes CRISPR no olho e sugeriu que a abordagem era segura e eficaz. A forma de edição básica do CRISPR também mostrou resultados promissores na redução dos níveis de colesterol durante um pequeno ensaio.
Além dos cuidados de saúde, a edição CRISPR tem sido utilizada para melhorar pelo menos 41 culturas alimentares , incluindo arroz e trigo, melhorando a sua palatabilidade, valor nutricional e resistência a doenças. Também tem sido usado para editar genes de porcos cujos órgãos são colhidos para operações de transplante humano.
Além disso, Van Eenennaam usa CRISPR em experimentos de prova de conceito para dotar animais de criação com características desejáveis. Por exemplo, ela aumenta o rendimento da carne do gado para que os agricultores possam criar menos gado e, assim, limitar o seu impacto ambiental.
Quais são os perigos e desvantagens potenciais do CRISPR?
CRISPR é uma ferramenta versátil e poderosa de edição de genoma, mas neste momento apresenta algumas limitações e riscos e também levanta dilemas éticos.
Por exemplo, no que diz respeito ao tratamento de doenças genéticas, algumas pessoas aceitam as suas condições e não as consideram como doenças , disse Van Eenennaam. Por exemplo, "você deveria 'curar' a surdez hereditária nos filhos de um casal surdo que não acredita que a surdez seja uma coisa ruim?" ela questionou.
Em relação às limitações do CRISPR, ele pode introduzir “efeitos fora do alvo” se a enzima Cas9 cortar o DNA em locais não intencionais do genoma. Isso pode ocorrer se os pesquisadores não personalizarem a sequência guia de RNA para um alvo de DNA único, mas, em vez disso, direcionarem uma sequência comum encontrada em uma família de genes. Tais efeitos fora do alvo podem ter resultados negativos para a saúde. Por exemplo, se o RNA guia corresponder a um gene que suprime o crescimento do tumor, existe o risco de que a sua desactivação possa tornar a célula cancerosa.
Outra questão é que a edição CRISPR não é 100% eficiente , portanto, apenas uma proporção das células-alvo sofre a alteração genética desejada. Isso significa que, em alguns cenários, as células não editadas podem evitar efeitos prejudiciais fora do alvo e, portanto, se sair melhor do que as células editadas e, eventualmente, superá-las em número. Pesquisadores descobriram recentemente que células-tronco sanguíneas editadas podem morrer com o tempo , sugerindo que os tratamentos para distúrbios sanguíneos podem se tornar menos eficazes no longo prazo.
Estes riscos também colocam considerações éticas relativamente à utilização de CRISPR na pecuária. Van Eenennaam normalmente usa “ edição de linhagem germinativa ” na pecuária, que envolve atingir células sexuais, como óvulos e espermatozoides, ou óvulos fertilizados. Isso torna as edições CRISPR hereditárias entre um animal e sua prole. O grupo de Van Eenennaam não insere genes recém-projetados no gado, mas sim transfere genes desejáveis existentes de uma vaca para outra.
Relacionado: Terapia genética: o que é e como funciona?
Há uma chance de que edições fora do alvo possam prejudicar a saúde dos animais. Mas Van Eenennaam argumenta que estas preocupações são muitas vezes exageradas. “Haverá literalmente milhões de variações genéticas entre dois touros” resultantes de mutações naturais, por isso os efeitos fora do alvo são apenas uma gota no oceano, explicou ela.
Ainda assim, a Food and Drug Administration (FDA) dos EUA afirma que a edição do genoma de animais de criação requer ampla supervisão , em parte porque outras sequências de ADN acompanham frequentemente o novo gene inserido no genoma. Essas transferências devem ser examinadas para garantir que não sejam perigosas para os animais ou para os consumidores humanos, diz o FDA. Se a agência considerar que um animal editado é de baixo risco, pode conceder “ discricionariedade de aplicação ” que permita que ele e seus descendentes sejam comercializados, observou Van Eenennaam.
Este tipo de edição de linhagem germinativa raramente foi aplicado a humanos , exceto no controverso caso em que um cientista chinês gerou de forma infame “bebês CRISPR” em violação dos regulamentos. Uma grande razão pela qual a edição da linha germinativa humana foi evitada é que as gerações futuras não podem consentir em receber um tratamento CRISPR.
As gerações futuras também não podem consentir com a possibilidade de efeitos nocivos fora do alvo, tais como mutações que poderiam predispor ao cancro. Nita Farahany , bioeticista da Duke University, disse ao New York Times que editar embriões seria antiético “até que possamos descobrir quais são os efeitos fora do alvo e como podemos controlá-los”.
As Academias Nacionais de Ciências, Engenharia e Medicina estabeleceram critérios que devem ser atendidos para que os ensaios clínicos de edição de linha germinativa avancem. O grupo aconselha restringir a edição da linha germinal humana apenas aos genes cujas mutações podem levar a doenças graves para as quais não existem outras terapias.
Atualmente, as terapias genéticas utilizam principalmente uma técnica chamada “ edição somática ”. Isto se aplica ao Casgevy, por exemplo. A edição somática funciona visando um subconjunto de células não sexuais no corpo e, portanto, não transmite quaisquer alterações às gerações seguintes.
“O benefício supera claramente qualquer risco hipotético” nestes contextos, disse Van Eenennaam, portanto a edição somática do CRISPR é um “acéfalo” quando se trata de terapia genética.
Nota do editor: Uma nova versão deste artigo foi publicada em 1º de julho de 2024. A versão anterior foi atualizada pela última vez em março de 2023.
Você já se perguntou por que algumas pessoas constroem músculos com mais facilidade do que outras ou por que as sardas aparecem ao sol ? Envie-nos suas perguntas sobre como o corpo humano funciona para community@livescience.com com o assunto "Health Desk Q" e você poderá ver sua pergunta respondida no site!

Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.