Uma reavaliação da posição taxonômica dos mesossauros e uma filogenia surpreendente dos primeiros amniotas
- 1 CR2P (UMR 7207) Centro de Investigação em Ciências da Vida e dos Palácios (Centro Nacional de Investigação Científica / MNHN / UPMC, Sorbonne Universités), Paris, França
- 2 Departamento de Paleontología, Faculdade de Ciências, Universidade da República, Montevidéu, Uruguai
Reavaliamos a posição filogenética dos mesossauros usando uma matriz de
dados que é atualizada e ligeiramente expandida a partir de uma matriz
que o primeiro autor publicou em 1995 com seu ex-orientador de tese.
A matriz revisada, que incorpora informações anatômicas publicadas nos
últimos 20 anos e observações sobre vários espécimes de mesossauro (a
maioria do Uruguai) inclui 17 táxons terminais e 129 caracteres (mais
quatro taxa e cinco caracteres a mais do que a matriz original de 1995). A nova matriz também difere incorporando mais caracteres ordenados (todas as morfoclinetas foram ordenadas).
Análises de parcimônia no PAUP 4 usando o algoritmo branch and bound
mostram que a nova matriz suporta uma posição de mesossauros na própria
base do Sauropsida, como sugerido pelo primeiro autor em 1995.
A
exclusão de mesossauros de um clado menos inclusivo de sauropsídeos é
apoiada por um índice de Bremer (Decay) de 4 e uma freqüência de
bootstrap de 66%, ambos os quais sugerem que este resultado é
moderadamente robusto. As árvores mais parcimoniosas incluem alguns resultados inesperados, como colocar o réptil Paleotyris
anapsídeo perto da base dos diapsídeos, e todos os pararópteis como o
grupo-irmão dos jovensiniformes (os mais diapsídeos da coroa incluídos
nas análises).
As tartarugas são colocadas entre os pararépteis, como o grupo-irmão
dos pareiasauros (e nos diapsídeos, dado que os pararóptiles estão
aninhados dentro dos diapsídeos).
Esse resultado inesperado oferece uma solução potencial para a longa
controvérsia sobre a posição das tartarugas, porque estudos anteriores
viam uma posição entre os diáspidos e entre os pararópteis como
alternativas mutuamente exclusivas.
Introdução
Mesossauros, um pequeno clado (os três gêneros nominais e espécies
geralmente reconhecidas estão atualmente em revisão) dos primeiros
amniotas permianos conhecidos da América do Sul (Brasil e Uruguai) e sul
da África (Namíbia e África do Sul) são notáveis em vários aspectos (
Piñeiro, 2008). ). Eles são os únicos amniotas do Permiano Antigo conhecidos de altas latitudes.
Há muito que são considerados marinhos, mas um estudo recente do seu
paleoambiente sugere que eles habitavam um mar moderadamente hipersalino
( Piñeiro et al., 2012c ). Da mesma forma, as sugestões ocasionais de que eles eram piscívoros (por exemplo, Bakker, 1975
) parecem improváveis porque os poucos acantodianos e actinopterígios
que ocorrem nas mesmas formações dos mesossauros parecem estar
presentes em diferentes estratos, e o conteúdo estomático dos
mesossauros é conhecido por conter somente crustáceos pygocephalomorph e
possivelmente, mesossauros mais jovens, que podem representar embriões
ainda no útero ( Piñeiro et al., 2012a ) ou carniça ( Silva et al., 2017 ). Os mesossauros aparentemente capturavam suas presas com seus longos dentes esguios e longos.
Eles mediram tipicamente <2 0="" a="" aparentemente="" com="" comprimento="" de="" e="" em="" estimada="" href="https://translate.googleusercontent.com/translate_c?depth=1&hl=pt-BR&rurl=translate.google.com&sl=auto&sp=nmt4&tl=pt-BR&u=https://www.frontiersin.org/articles/10.3389/feart.2017.00088/full&xid=17259,15700023,15700186,15700190,15700256,15700259,15700262,15700265&usg=ALkJrhi1IJ_8SSoF9gHBINeImE_a9x1eMQ#B81" m="" muito="" n="" nadaram="" nata="" no="" o="" pido="" r="" s="" tima="" total="" uma="" velocidade="">Villamil et al., 2016
Os mesossauros foram os primeiros amniotas a retornar a um estilo de vida aquático ( Canoville e Laurin, 2010 ).
Embora a incerteza continue sobre o quão terrestre foram os primeiros
amniotas, o mais recente estudo microanatômico sugere que eles se
tornaram razoavelmente terrestres ( Laurin e de Buffrénil, 2016 ). Romer (1957 , 1958)
sugeriu inicialmente que os primeiros amniotas ainda eram em grande
parte aquáticos para os anfíbios e chegavam à terra principalmente para
botar ovos.
Esta ideia baseou-se em grande parte no estilo de vida primitivamente
aquático para o estilo de vida anfíbio de limnoscelids (que permanecem a
ser avaliado usando microanatomia óssea) e do início do sinapsídeo Ophiacodon . No entanto, agora parece que Ophiacodon era mais terrestre do que se pensava inicialmente, e os clepsidropes geofeneticamente mais antigos têm uma microanatomia óssea tipicamente terrestre ( Felice e Angielczyk, 2014 ; Laurin e de Buffrénil, 2016 ). Isso deixa os mesossauros como os primeiros amniotas a voltarem a um estilo de vida claramente aquático.
Os mesossauros também documentam o primeiro caso de retenção prolongada de embriões, provavelmente na forma de viviparidade ( Piñeiro et al., 2012a
), uma vez que a maioria das pistas utilizadas para sugerir
viviparidade em vários amniotas marinhos mesozóicos também ocorre em
mesossauros, exceto para embriões envolvidos nos canais de nascimento,
documentados até agora apenas em ictiossauros ( Motani et al., 2014 ).
Estes incluem indivíduos muito pequenos presentes na cavidade abdominal
de muito maiores, embora alguns possam representar canibalismo em vez
de viviparidade, bem como cuidado parental dos juvenis ( Piñeiro et al., 2012a ).
Por último, mas não menos importante, supõe-se que os mesossauros
tenham sido ou o grupo-irmão de um grande clado que inclui os
parapépteis e eureptiles ( Laurin e Reisz, 1995 ) ou os pararóptiles basais ( Modesto, 1999 ). Tudo isso, aliado à presença de fenestração temporal nos mesossolos ( Piñeiro et al., 2012b ), faz com que a reavaliação das afinidades taxonômicas dos mesossauros seja oportuna.
Este estudo não faz nenhuma tentativa séria de reavaliar a origem das
tartarugas, um tópico fascinante, mas desafiador, que exigiria um papel
próprio. Até a década de 1990, as tartarugas eram consideradas estreitamente relacionadas com os eurepteis de captoríneos ( Clark e Carroll, 1973 ; Gauthier et al., 1988 ), que, como todas as tartarugas existentes, têm uma configuração temporal anapsídica.
Na década de 1990, o consenso mudou para uma origem de tartarugas entre
os pararépteis, seja como grupo-irmão de procolonóides ( Reisz e Laurin, 1991 ; Laurin e Reisz, 1995 ) ou de pareiasauros ( Lee, 1993 , 1996 ; Lyson et al., 2010 ), antes de mudar rapidamente (embora não unanimemente) para uma origem entre diapsídeos, baseada em dados morfológicos ( Rieppel e DeBraga, 1996 ; deBraga e Rieppel, 1997 ) e moleculares ( Hugall et al., 2007 ; Chiari et al., 2012 ). Uma possível tartaruga-tronco, que parece ter fenestras temporais superiores ( Schoch e Sues, 2015 , 2017 ), reforça essa hipótese.
Para complicar ainda mais, alguns estudos recentes sugerem que a
posição das tartarugas é difícil de resolver com confiança, porque
vários genes sugerem histórias conflitantes, e que isso reflete o
"verdadeiro estado da natureza" ( Lu et al., 2013 ).
Assim, reavaliar essa questão seriamente seria necessário adicionar
muitos táxons adicionais e, idealmente, incorporar dados moleculares e
morfológicos. Claramente, este é um esforço distinto de avaliar as afinidades dos mesossauros, que é o objetivo que buscamos neste estudo.
No entanto, a amostra taxonômica selecionada aqui pode permitir um
teste muito limitado de onde, entre os pararépteis, as tartarugas se
encaixam, se elas se encaixam.
A diversidade de diáspsidos é grande e, dado que muito pouco dela é
amostrado aqui, o nosso estudo não foi concebido para tentar avaliar os
méritos relativos destas duas hipóteses concorrentes (tartarugas dentro e
fora dos diapsídeos).
Dada a controvérsia em torno das afinidades das tartarugas, neste
trabalho, essa palavra vernacular se referirá às tartarugas-coroas, bem
como todas as tartarugas-tronco indubitavelmente com pelo menos uma
carapaça parcial, ou seja, entre os taxa discutidos abaixo, Proganochelys e Odontochelys .
Métodos
Seleção de táxon
Começamos a partir da matriz de Laurin e Reisz (1995)
, uma vez que essa era a matriz que conhecíamos melhor, que tínhamos
confiança na precisão da pontuação anatômica e que estávamos confiantes
de que poderíamos aplicar as pontuações revisadas em um maneira coerente
com a pontuação original.
Este último ponto é particularmente importante porque, mesmo se uma
matriz foi pontuada por um sistematista de uma maneira perfeitamente
coerente e justificada, outro sistematista pode pontuar taxa adicionais,
ou revisar a pontuação baseada em novas informações, de uma maneira que
seja internamente coerente, mas incoerente. com a pontuação original.
Usar de forma confiável uma matriz produzida por outros autores requer a
avaliação de como os estados foram concebidos e delimitados, e
aplicando as mesmas delimitações nas pontuações revisadas ou novas.
Como explicado acima, nossa seleção de táxons é inadequada para testar a
posição das tartarugas (dentro vs. fora dos diapsídeos).
Portanto, algumas análises de sensibilidade foram realizadas para
avaliar a robustez de nossas conclusões para a inclusão ou exclusão de
tartarugas;
Isso permite avaliar se a posição das tartarugas (perto dos mesossolos,
entre os pararópteis, ou muito mais longe, no interior dos diapsídeos)
tem impacto na avaliação das afinidades dos mesossauros ou na robustez
de nossas conclusões. Os únicos taxa adicionais, em comparação com a matriz de Laurin e Reisz (1995), são, portanto, o acleistorhinus do primeiro pararéptil , que é agora muito mais conhecido devido à descrição anatómica dada por de Braga e Reisz (1996) , o procolofonoide Owenetta kitchingorum , que foi minuciosamente descrito por Reisz e Scott (2002) e Odontochelys da tartaruga-caule ( Li et al., 2008 ). Nós também dividimos o OTU Testudines, que incorporou o Proganochelys na pontuação de Laurin e Reisz (1995) , em Proganochelys e Chelonii separados, que pontuamos com base em todas as tartarugas que coroam o Proganochelys .
A fonte das pontuações está documentada no arquivo Mesquite Nexus (SOM
1, no site da HAL) como notas em células individuais e na célula do nome
do táxon, mas no caso de Chelonii, a pontuação é baseada em várias
tartarugas-tronco, tais como Australochelys ( Gaffney e Kitching, 1995 ), Condorchelys ( Sterli , 2008 ) , Palaeochersis ( Sterli et al., 2007 ) , Kayentachelys ( Sterli e Joyce, 2007 ), e Indochelys ( Datta et al., 2000 ), além disso às coroas-tartarugas existentes e extintas ( Gaffney, 1979 ; Gaffney et al., 2006 ). A matriz revisada, portanto, tem 17 táxons terminais, acima de 13 táxons em Laurin e Reisz (1995) .
Nós deliberadamente mudamos o nome do OTU, incluindo tartarugas
existentes e parte de seu tronco de Testudines para Chelonii, para
chamar a atenção para o fato de que este OTU mudou um pouco.
A escolha do nome é ainda mais justificada pelo fato de que Brongniart (1800)
foi o primeiro a erigir um taxon mais alto da série de classes (que
engloba ordens), ao invés de séries familiares que englobavam todas ou a
maioria das tartarugas que eram então conhecido, e ele chamou de
"Chéloniens", logo depois latinizado como "Chelonii" por Latreille (1800 ; ver também Dubois e Bour, 2010 ).
O código zoológico não inclui regras de prioridade para nomina de série
de classe, mas por analogia a tais regras para nomina de família e
gênero, Dubois e Bour (2010)
sugerem usar este nome, e sua sugestão é seguida aqui, dado que o O
nome Testudines foi claramente concebido como gênero e série familiar. Por fim, observe que a composição de Chelonii, tal como aqui delimitada, não combina com Testudines, conforme definido por Joyce et al. (2004) , que aplica a coroa de tartaruga.
Codificação de caracteres
Nós não adicionamos novos caracteres à matriz (apesar de dividirmos
alguns; veja abaixo), mas pedimos alguns caracteres porque eles parecem
formar morfoclininas. A esse respeito, nossa abordagem difere daquela seguida por Laurin e Reisz (1995) , que citamos na íntegra porque é altamente relevante para o que segue. Eles afirmaram: “Alguns personagens foram ordenados neste estudo (Apêndice 1 em Material Complementar). A controvérsia sobre se os caracteres multiestado devem ser ordenados ou deixados desordenados não está resolvida. Alguns argumentaram contra o uso de caracteres ordenados ( Mabee, 1989 ; Hauser e Presch, 1991 ), enquanto outros argumentaram que os caracteres deveriam ser ordenados quando possível ( Mickevich e Lipscomb, 1991 ; Slowinski, 1993 ). Nós usamos uma abordagem mista.
Todos os caracteres multi-estado exibindo o que parecia ser uma
morfocline foram mapeados na árvore mais curta (encontrada apenas com
caracteres não ordenados) usando MacClade 3.0 ( Maddison e Maddison, 1992 ). Quando a otimização do personagem suportava a existência de uma morfocline, o personagem era ordenado.
Suporte para a morfocline requer que todas as transformações de estado
para o caracter relevante sejam compatíveis com a morfocline. Se uma única transformação fosse ambígua, o caractere não foi ordenado. Este procedimento nos permitiu solicitar seis caracteres (Anexo 1 em Material Complementar) ”.
Nos mais de 20 anos que se passaram após a publicação desse artigo, um de nós (ML) se envolveu em pesquisas sobre esse tema ( Grand et al., 2013 ; Rineau et al., 2015
), e esse trabalho baseado em simulação mostrou claramente que os
caracteres que formam as morfoclinetas devem ser ordenados porque isso
maximiza o poder de resolução (a capacidade de recuperar os clades
corretos) e minimiza as falsas resoluções (cliques artificiais). O critério adicional invocado por Laurin e Reisz (1995)
consistindo em exigir que a otimização de cada caractere inicialmente
não ordenado seja totalmente compatível com o esquema de ordenação agora
parece inválida, por duas razões principais.
Primeiro, isso pressupõe que a árvore obtida inicialmente é a correta, o
que nunca é certo em um estudo empírico, e menos ainda se o esquema de
ordenação de caracteres de múltiplos estados for sub-ótimo.
A esse respeito, observe que, no caso extremo de cada táxon tendo um
estado diferente, um caractere não ordenado não tem conteúdo de
informação filogenética, enquanto um caractere ordenado transmitirá o
conteúdo máximo de informação filogenética.
Em segundo lugar, exigir a otimização do estado para coincidir com a
suposta morfocline na árvore pressupõe que todos os taxa relevantes
tenham sido incluídos.
Em geral, esse não é o caso, por várias razões: a maioria dos estudos
empíricos não inclui todas as espécies existentes de um clado; em alguns táxons, apenas uma pequena fração da biodiversidade existente foi descrita ( Mora et al., 2011 );
nem todos os táxons extintos (se houver) conhecidos do registro fóssil
são tipicamente incluídos, e em qualquer caso, o registro fóssil da
maioria dos taxa é, na melhor das hipóteses, fragmentário ( Foote e Sepkoski, 1999 ; Didier et al., 2017 ).
Assim, essa segunda razão seria mais do que suficiente para não exigir
que os esquemas de ordenação a priori fossem validados por meio da
otimização de estados não ordenados em uma árvore.
Muitos mais caracteres (21) foram assim ordenados. Estes são (em nossa numeração; isso não corresponde aos números em Laurin e Reisz, 1995 ): 6, 15, 17, 19, 25, 35, 37, 40, 49, 51, 57, 74, 85, 93, 99 , 101, 110, 112, 121, 123 (que foi binário em Laurin e Reisz, 1995 ), 128 e 129. Em alguns casos, os estados tiveram que ser reordenados porque o esquema inicial de Laurin e Reisz (1995) tinha estado 0 como o estado primitivo; este não é necessariamente o caso aqui porque a condição primitiva pode estar no meio de uma morfocline.
Assim, os estados não foram necessariamente listados por Laurin e Reisz (1995) em uma ordem coerente com uma morfocline. Isso não foi problemático para Laurin e Reisz (1995), uma
vez que eles trataram esses caracteres como desordenados, mas tratá-los
como morfoclinmas, como feito aqui, requer reordenar os estados. Os únicos casos difíceis são aqueles em que a morfocline parece provável, mas não absolutamente certa. Por exemplo, pedimos o caráter 48 [ectopterygoid: large (0); pequeno (1);
ausente (2)] porque nós hipotetizamos que o ectopterygoid foi perdido
através de edução em tamanho ao invés de fusão a um elemento vizinho,
uma hipótese apoiada pelo fato de que algumas amniotas Permianas, como, O. kitchingorum ( Reisz e Scott, 2002
) têm um ectopterygoid diminutivo, e pelo fato que não há evidência
firme que este osso fusionou a ossos vizinhos em amniotes ou em
lissamphibians ( Müller et al., 2005 ).
Em um contexto taxonômico mais amplo, isso também é consistente com a
descoberta de que, em temnospondylos, os parentes mais próximos de Doleserpeton
, que não possuem um ectopterygoid, têm um pequeno ectopterygoide,
embora os lepospondylis aparentemente forneçam um contra-exemplo ( Kimmel et al., 2009 ). No entanto, se essa hipótese se revelar falsa, essa ordenação seria injustificada.
Mais informações sobre os caracteres que foram ordenados e os esquemas
de ordenação exatos podem ser vistos em SOM 1 (a matriz em um formato
Mesquite Nexus).
No mesmo espírito, também dividimos alguns caracteres que pareciam
abranger dois ou mais caracteres distintos, ou caracteres mesclados que
parecem refletir uma única cline. Assim, o caráter 27 ("occipital flange of squamosal"), de Laurin e Reisz (1995)
, foi dividido em dois caracteres (aqui, números 27 e 28) porque
achamos que o caráter original pode ser melhor considerado consistindo
em dois logicamente. caracteres independentes.
A formulação inicial, portanto, incluiu seis estados: “Flange Occipital
de squamosal: em entalhe ótico e sobrepõe-se a pterigoide (0); suavemente convexo ao longo de toda a borda posterior do crânio (1); convexa acima da emarginação quadrada e côncava medial ao sulco timpânico (2); ausente (3); medial à crista timpânica, voltada para o sentido póstero-medial (4);
medialmente à crista timpânica, côncava, voltada para o póstero-lateral
ou ventrolateral (5). ”Esses seis estados eram desordenados e, na
verdade, é difícil ver como eles poderiam ter sido ordenados, mas isso
tornou esse caráter de pouca utilidade, dado que havia 13 OTUs.
Nós pensamos que é melhor separar a presença ou ausência de uma
contribuição squamosal para o entalhe ótico ou para a emarginação
quadrada (na emarginação) e a posição do esquamosal, seja principalmente
na bochecha (condição primitiva) ou em grande parte na mesa craniana.
(condição derivada). Esses dois caracteres binários podem capturar a maior parte do conteúdo de informações desse caractere.
Sob a formulação inicial e a nova, a pontuação precisa requer crânios
razoavelmente não distorcidos, porque em casos severamente achatados, a
orientação exata do segmento horizontal seria difícil de determinar.
Por outro lado, os caracteres 24 e 25 (região maxilar e dente maxilar)
foram mesclados em um único caractere ordenado, pois podem ser
conceituados como diferenciação crescente da linha de dentes, de uma
linha de dentes homogênea para a presença de uma região caniniforme e,
finalmente, a presença de um dente caniniforme genuíno (um dente muito
maior do que os vizinhos; duas posições podem estar em causa, mas
normalmente apenas uma é ocupada por um dente, devido ao padrão de
substituição contínua).
Pontuação de Personagem
As pontuações que foram alteradas em relação a Laurin e Reisz (1995) são destacadas em amarelo no SOM 1. Nem todas devem ser comentadas aqui, mas alguns destaques podem ser dados. Para os mesossauros, alguns escores que eram desconhecidos (?) Na matriz de Laurin e Reisz (1995)
foram inseridos com base em observações pessoais dos autores sobre
vários espécimes feitos nos últimos 5 anos, principalmente das coleções
da Faculdade de Ciências. da Universidade da República (Montevidéu). Essas coleções incluem dezenas de espécimes de Mesossauro da Formação Early Manmullo Permiano (Uruguai). Em menor medida, também exploramos coleções no Brasil, na Alemanha e na coleção mais limitada de mesossauros em Paris. A lista de espécimes de Mesosaurus estudados é fornecida no SOM 2, uma tabela detalhando o número do espécime, proveniência geográfica e breve descrição.
Além disso, também verificamos a literatura para revisar toda a matriz,
ocasionalmente revisando a pontuação, sempre que necessário.
Algumas das revisões podem ser comentadas aqui. O forame orbitonasal (caráter 10) não foi documentado em Laurin e Reisz (1995) , mas nossas observações sugerem que ele está ausente nos mesossauros. Da mesma forma, um contato pós-orbital / supratemporal (caráter 12), pontuado como estando presente nos mesossauros por Laurin e Reisz (1995) é agora considerado como ausente ( Piñeiro et al., 2012b ). O pós-orbital é agora também considerado longe do occipital (personagem 13), enquanto Laurin e Reisz (1995) o classificaram como próximo (Figura 1 , 2 ).
FIGURA 1
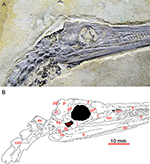 Figura 1 Crânio do mesossauro tenuidens (GP-2E-669a) em vista lateral direita mostrando a fenestra temporal inferior; imagem (A) e desenho de linha com etiqueta interpretativa (B) .
Este espécime é um crânio quase completo e parte do esqueleto
pós-craniano (não mostrado) alojado na Coleção de Vertebrados Fósseis do
Instituto de Geociências da Universidade de São Paulo. Barra de escala: 10 mm. a, angular; eixo, eixo; cev, vértebra cervical; d, dentário; f, frontal; j, jugal; l, lacrimal; ltf, fenestra temporal inferior; mx, maxila; n, nasal; p parietal; pf, pós-frontal; po, pós-orbital; pp, pós-parietal; prf, pré-frontal; q, quadrate; qj, quadratojugal; sa, surangular; sm, septomaxilla; sp, esplenial; sq, squamosal; supratemporal.
Figura 1 Crânio do mesossauro tenuidens (GP-2E-669a) em vista lateral direita mostrando a fenestra temporal inferior; imagem (A) e desenho de linha com etiqueta interpretativa (B) .
Este espécime é um crânio quase completo e parte do esqueleto
pós-craniano (não mostrado) alojado na Coleção de Vertebrados Fósseis do
Instituto de Geociências da Universidade de São Paulo. Barra de escala: 10 mm. a, angular; eixo, eixo; cev, vértebra cervical; d, dentário; f, frontal; j, jugal; l, lacrimal; ltf, fenestra temporal inferior; mx, maxila; n, nasal; p parietal; pf, pós-frontal; po, pós-orbital; pp, pós-parietal; prf, pré-frontal; q, quadrate; qj, quadratojugal; sa, surangular; sm, septomaxilla; sp, esplenial; sq, squamosal; supratemporal.
FIGURA 2
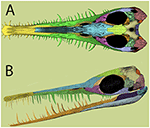 Figura 2 Reconstrução de crânio de mesossauro com base em evidências recentes. (A) vista dorsal; (B) , vista lateral. Modificado de Piñeiro et al. (2012b) .
Figura 2 Reconstrução de crânio de mesossauro com base em evidências recentes. (A) vista dorsal; (B) , vista lateral. Modificado de Piñeiro et al. (2012b) .
Havia um problema com o personagem 22 (contato maxila / quadratojugal),
para o qual a lista de estados havia sido invertida no Apêndice 1 em
Material Complementar (lista de caracteres e estados) de Laurin e Reisz (1995) , embora tenham sido corretamente o texto principal e no Apêndice 2 em Material Complementar (a matriz de dados).
A codificação correta é que o estado 0 (a condição primitiva) consiste
em separar os dois ossos em visão lateral, e essa condição prevalece nos
mesossauros (Figuras 1 e 2 ).
A fenestra temporal inferior (caráter 32), considerada como ausente em Laurin e Reisz (1995), é agora considerada presente ( Piñeiro et al., 2012b ), conforme corretamente avaliado por nosso grande predecessor ( Huene, 1941 ).
Considera-se agora que o osso tabular foi de tamanho médio (personagem
17), um estado que estava ausente da codificação inicial.
O jugal foi mudado de não alcançar a borda orbital anterior (como codificado em Laurin e Reisz, 1995 ) para atingir esse nível. Essa condição é mostrada em espécimes uruguaios ( Piñeiro et al., 2012b , Figura 1; Figura 1 ).
Os mesossauros parecem ter uma baixa eminência maxilar ( Piñeiro et al., 2012b , Figura 1), que até parece ter contato com a nasal em uma sutura curta entre a narina externa e o forame nariale obturatum.
No entanto, dado que essa baixa eminência atinge sua extensão máxima
anterior e logo posterior à narina externa, consideramos que ela não é
homóloga ao processo anterior encontrado em vários outros amniotas, como
Acleistorhinus ( deBraga e Reisz, 1996 ). Para esclarecer isso, acrescentamos, na formulação do caráter, que esse processo está localizado na parte posterior da naris.
Surpreendentemente, os mesossauros parecem ter um esbelto estribo em
todos os estágios ontogenéticos nos quais está documentado (Figura 3 ).
Não há evidências de que tenha sido associado a um tímpano (personagem
69), o que não faria sentido em animais aquáticos como os mesossauros.
FIGURA 3
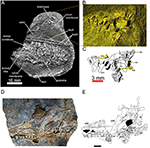 Figura 3 Dois espécimes de Mesossauro tenuidens com o estribo. Feto quase completo em estágio avançado de desenvolvimento (FC-DPV 2504) em (A) visão geral, com uma figura (B) e desenho de linha marcado (C) da caixa craniana, incluindo elementos occipitais e estribo, que foram deslocados de o resto da amostra. Figura (D) e desenho de linha rotulado (E)
de uma segunda amostra adulta quase completa, mas ligeiramente
desarticulada (FC-DPV 3067) mostrando a caixa craniana com o estribo
direito aproximadamente em sua posição anatômica (embora sua ponta
distal tenha se movido anteriormente). Nos desenhos interpretativos (C, E) , o estribo é destacado em amarelo. Ambos os espécimes são da Early Manmullo Permian Formation of Uruguay. Escala para (D, E) 10 mm. Abreviaturas anatômicas: perguntar, crânio anterior; bo, basioccipital; bpt, basipterygoid; cev, vértebras cervicais; eo, exoccipital; ga, gastralia; op, opistotic; pbs, parabasisphenoid; pro, proótico; psk, crânio posterior; qj, quadratojugal; assim, supra-occipital; sta, stapes.
Figura 3 Dois espécimes de Mesossauro tenuidens com o estribo. Feto quase completo em estágio avançado de desenvolvimento (FC-DPV 2504) em (A) visão geral, com uma figura (B) e desenho de linha marcado (C) da caixa craniana, incluindo elementos occipitais e estribo, que foram deslocados de o resto da amostra. Figura (D) e desenho de linha rotulado (E)
de uma segunda amostra adulta quase completa, mas ligeiramente
desarticulada (FC-DPV 3067) mostrando a caixa craniana com o estribo
direito aproximadamente em sua posição anatômica (embora sua ponta
distal tenha se movido anteriormente). Nos desenhos interpretativos (C, E) , o estribo é destacado em amarelo. Ambos os espécimes são da Early Manmullo Permian Formation of Uruguay. Escala para (D, E) 10 mm. Abreviaturas anatômicas: perguntar, crânio anterior; bo, basioccipital; bpt, basipterygoid; cev, vértebras cervicais; eo, exoccipital; ga, gastralia; op, opistotic; pbs, parabasisphenoid; pro, proótico; psk, crânio posterior; qj, quadratojugal; assim, supra-occipital; sta, stapes.
O número de ossos coronóides não é claro. Alguns de nossos espécimes podem mostrar dois, mas essa interpretação é altamente experimental. Nós não vemos fortes evidências de que houve um único coronoide também. Assim, mudamos a pontuação de um único coronoide (em Laurin e Reisz, 1995 ) para desconhecido.
Atualizamos o número de ossificações escapulocoracoides de três para apenas duas ( Piñeiro, 2004 ; Modesto, 2010 , p. 1387).
Laurin e Reisz (1995)
tinham um caráter (102) intitulado “forame e sulco ectopicondilares”.
Dado que o sulco pode ocorrer sem o forame, e que um forame pode ocorrer
sem um sulco (sempre que o forame leva a um canal que é nitidamente em
ângulo em relação à superfície óssea), decidimos dividi-los em dois
caracteres. Os mesossauros foram classificados por Laurin e Reisz (1995) como tendo apenas o sulco, ou o sulco e forame. Nossas observações sugerem que o forame está sempre presente, embora nem sempre seja fácil de observar (Figura 4 ). Portanto, marcamos ambos como presentes.
FIGURA 4
 Figura 4 Espécimes de mesossauro tenuidens mostrando como parte e contraparte podem levar a interpretações divergentes sobre a presença do forame ectepicondilar. (A – C)
FC-DPV 2042, 2488 e 2103, respectivamente, fotografias de vários úmeros
de indivíduos adultos da Formação Mangrullo do Uruguai, mostrando a
presença tanto do forame ectepicondilar (seta vermelha) quanto do sulco. Barras de escala: 3 mm. (D, E) FC-DPV 2385 fotografias de uma região de tronco de mesossauro parcialmente articulada preservada como parte (D) e contraparte (E) . O úmero em (D) sugere que o forame ectepicondilar não está presente, mas pode ser visto perfeitamente em (E) . Barra de escala: 2 mm.
Figura 4 Espécimes de mesossauro tenuidens mostrando como parte e contraparte podem levar a interpretações divergentes sobre a presença do forame ectepicondilar. (A – C)
FC-DPV 2042, 2488 e 2103, respectivamente, fotografias de vários úmeros
de indivíduos adultos da Formação Mangrullo do Uruguai, mostrando a
presença tanto do forame ectepicondilar (seta vermelha) quanto do sulco. Barras de escala: 3 mm. (D, E) FC-DPV 2385 fotografias de uma região de tronco de mesossauro parcialmente articulada preservada como parte (D) e contraparte (E) . O úmero em (D) sugere que o forame ectepicondilar não está presente, mas pode ser visto perfeitamente em (E) . Barra de escala: 2 mm.
Todas essas mudanças na pontuação, e outras não comentadas aqui por
falta de espaço, são documentadas no SOM 1, um arquivo Mesquite Nexus
que incorpora a matriz de dados e várias árvores, que podem ser
acessadas no arquivo aberto do HAL ( https: // hal. archives-ouvertes.fr/ ) através deste link: https://hal.archives-ouvertes.fr/hal-01618314 . Note que o formato Nexus também pode ser lido por MacClade 3.0 ( Maddison e Maddison, 1992 ) e PAUP 4.0 ( Swofford, 2003 ), mas o amarelo destacando para marcar as mudanças é visível apenas em Mesquite.
Análise filogenética
A matriz de dados foi analisada usando parcimônia (com alguns estados
ordenados, como mencionado acima) usando o algoritmo branch and bound do
PAUP 4.0a155 ( Swofford, 2003 ), o que garante encontrar todas as árvores mais parcimoniosas ( Hendy e Penny, 1982 ). A robustez dos resultados foi avaliada tanto por análise bootstrap não paramétrica ( Felsenstein, 1985 ) com 200 réplicas e índice de decaimento (Bremer) ( Bremer, 1988 ), ambos usando o algoritmo branch and bound. As frequências de inicialização informadas abaixo são arredondadas para a porcentagem mais próxima.
Para estabelecer o número de etapas extras necessárias para mover os
mesossauros para locais alternativos na árvore, restrições topológicas
do esqueleto foram aplicadas.
Para avaliar a robustez de nossos resultados à amostragem taxonômica,
repetimos as análises com alguns taxa deletados (Mesosauridae, Chelonii,
Proganochelys e Odontochelys ).
Resultados
Amostra Taxonômica Exaustiva
A busca resultou em duas árvores mais parcimoniosas, exigindo 383
etapas, com um IC de 0,5666 e com um índice de retenção de 0,6605
(Figura 5 ). Todos os comprimentos relatados aqui foram computados em Mesquite 3.1, distinguindo entre incerteza parcial e polimorfismo;
sob as configurações padrão, o PAUP 4 considera tudo isso como
incerteza, embora as configurações possam ser alteradas para interpretar
esses dados como no Mesquite.
Isso introduz apenas uma diferença no comprimento das árvores entre os
dois programas, embora as árvores mais curtas em um programa permaneçam
as mais curtas no outro. Nessas árvores, os mesossauros aparecem como o grupo-irmão de todos os outros sauropsídeos, como estavam em Laurin e Reisz (1995) . No entanto, a filogenia dos sauropsídeos difere fortemente da topologia recuperada por Laurin e Reisz (1995)
e as mais recentes análises porque os parapépteis parecem ser aninhados
dentro de diapsídeos, como o grupo-irmão de jovensiniformes (mais
diapsídeos coronários não são incluídos em nossa amostra taxonômica). Não surpreendentemente, este resultado não é muito robusto;
o menor clado que inclui jovens uniformes e para-répteis tem um índice
de Bremer de 3 e uma frequência de bootstrap de apenas 39%. Essa baixa freqüência de bootstrap sugere um conflito considerável de caracteres. Os pareiasauros parecem ser o grupo-irmão das tartarugas, como sugerido anteriormente por Lee (1993 , 1996) , mas os procolonóides parecem ser parafiléticos, dado que o Procolophon está mais próximo daquele clado, nas árvores mais parcimoniosas, do que de O. kitchingorum . Além disso, o romeriid Paleothyris
aparece aninhado dentro dos diapsídeos, outro resultado
contra-intuitivo, embora este seja o clado menos robusto (índice de
Bremer de 1; frequência de bootstrap de 20%).
FIGURA 5
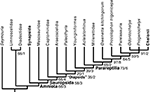 Figura 5 Posição filogenética dos mesossauros entre os primeiros amniotas e os táxons relacionados selecionados. Este cladograma resulta de uma análise de parcimônia de uma matriz atualizada a partir de Laurin e Reisz (1995)
com nossas observações de espécimes de mesossauro (principalmente de
material coletado no Uruguai, mas também, em menor grau, material
observado no Brasil, Alemanha e França) e com literatura recente. Personagens que formam um cline foram ordenados; o algoritmo branch and bound do PAUP 4 foi utilizado. Este é um consenso estrito de duas árvores que requerem 383 etapas (em Mesquite). Eles têm um IC (Índice de Consistência) de 0,56527 e um Índice de Retenção (RI) de 0,65741 (ver texto para detalhes).
Figura 5 Posição filogenética dos mesossauros entre os primeiros amniotas e os táxons relacionados selecionados. Este cladograma resulta de uma análise de parcimônia de uma matriz atualizada a partir de Laurin e Reisz (1995)
com nossas observações de espécimes de mesossauro (principalmente de
material coletado no Uruguai, mas também, em menor grau, material
observado no Brasil, Alemanha e França) e com literatura recente. Personagens que formam um cline foram ordenados; o algoritmo branch and bound do PAUP 4 foi utilizado. Este é um consenso estrito de duas árvores que requerem 383 etapas (em Mesquite). Eles têm um IC (Índice de Consistência) de 0,56527 e um Índice de Retenção (RI) de 0,65741 (ver texto para detalhes). A robustez dos resultados é mostrada através do bootstrap (baseado em 200 réplicas ramificadas e ligadas) e Bremer Index (antes e depois da barra, respectivamente). Note que os diapsídeos não formam um clado sob esta topologia, mas para tornar isso mais óbvio, o menor clado que inclui ambos os táxons diapsídeos é rotulado como “Diapsídeos”.
O clado que inclui todos os sauropsídeos exceto os mesossauros tem uma
freqüência de bootstrap de 66%, que é relativamente baixa, mas movendo
os mesossauros dentro do clado que inclui outros répteis, como
colocá-los na base dos pararépteis, como sugerido anteriormente por Gauthier e cols. . (1988 , Figura 4.4) e Modesto (1999 , Figura 4A), requer quatro etapas adicionais. Mover os mesossauros para outras posições filogenéticas requer três etapas adicionais (386).
Entre as 48 árvores desse comprimento, os mesossauros ocorrem em várias
posições, mas sempre fora do menor clado que inclui todos os outros
sauropsídeos.
Em quatro dessas árvores, os mesossauros são o grupo-irmão de um clado
que inclui amniotas e diadectomorfos (nos quais os diadectomorfos
aparecem na base de Synapsida); em três dessas árvores, os mesossauros são o grupo-irmão dos amniotas.
Nas outras 41 árvores desse comprimento, os mesossauros aparecem em sua
posição mais parcimoniosa, como o grupo-irmão de todos os outros
sauropsídeos.O clado mais frequente que inclui os mesossauros e um subconjunto dos outros sauropsídeos (neste caso, todos os outros, exceto Acleistorhinus ) tem uma baixa frequência de bootstrap (12%).
Os personagens discutidos abaixo foram apresentados em detalhes por Laurin e Reisz (1995) , com pouquíssimas exceções. Assim,
com exceção dos caracteres não retirados daquele artigo, a discussão
sobre a natureza desses caracteres é mantida curta, e a ênfase é dada à
sua distribuição taxonômica revisada.
O status de sauropsídeos dos mesossauros é suportado pelas quatro
sinapomorfias não ambíguas seguintes, dados nossos dados e as árvores
mais curtas (os números entre parênteses após um número de caractere
designam o estado do caractere):
Personagem 35 (1). Processo anterior quadrático curto. Este processo é longo em Seymouria
, limnoscelids e Synapsida (ancestralmente). Nesses táxons, esse
processo se sobrepõe a pelo menos metade do comprimento do ramo quadrado
do pterigóide. A condição derivada (processo curto que se sobrepõe a
menos da metade do quadrado do ramo pterigóideo) ocorre em mesossauros (
Modesto, 2006) , captorinídeos, paleotiris , araeoscelidianos e fetos jovens, mas os pararépteis revertem a ter um processo anterior longo.
Personagem 62 (1). Fenestra póstemporal grande. Em Seymouria , diadectídeos e sinapsídeos ancestrais, a fenestra póstemporal é pequena; parece quase como um grande forame. Mesossauros ( Modesto, 2006 , p. 347) e a maioria dos outros sauropsídeos, exceto Acleistorhinus , têm uma grande fenestra pós -temporal. A fenestra estava aparentemente convergentemente aumentada em limnoscelídeos.
Personagem 105 (1). Processo de supinação paralelo ao eixo. O processo de supinação era ancestralmente inclinado para o eixo, como visto em Seymouria , diadectomorfos e sinapsídeos iniciais. Todos
os primeiros sauropsídeos nos quais este personagem é documentado têm
um processo de supinação que é orientado em um ângulo muito menor do
eixo.
Personagem
123 (1). Presença de um único pedal central no adulto. Ancestralmente
em cotilossauros, dois pedal centralia estavam presentes, como visto em
diadectomorfos e a maioria dos sinapsídeos permo-carboníferos. Em
sinapsídeos, a situação é um tanto incerta. A maioria dos eupelycosaurs
tem dois centros, mas na Caseasauria não há evidência de dois centros; Casea é geralmente mostrada com dois, mas apenas um é realmente preservado ( Romer e Price, 1940 : Figura 41H), e em Cotylorhynchus apenas um é preservado, embora Stovall et al. (1966p.
24) indicam que a presença de uma segunda central é incerta.
O
polimorfismo poderia ter sido classificado para este táxon, mas dado o
quão pouco conhecido esse personagem é na Caseasauria, provisoriamente
mantivemos uma pontuação que representa a condição predominante em
Eupelycosauria, onde é muito melhor documentada ( Romer e Price, 1940
: Figura 41) . Sauropsídeos têm um único pedal central no adulto e não
há evidência forte de um segundo central em juvenis, embora a ontogenia
da maioria dos sauropsídeos paleozóicos (exceto os mesossauros) seja
muito pouco conhecida para ter certeza de que um segundo centrale estava
ausente na ontogenia inicial ( estado 2). A ontogênese bem documentada
dos mesossauros mostra que, nesse táxon, a fusão ocorreu bem tarde na
ontogenia (estado 1; Piñeiro et al., 2016).. A este respeito, os mesossauros podem exibir uma condição intermediária. Esse caractere é ordenado porque parece formar um cline.
A posição dos mesossauros fora do clado que inclui todos os outros sauropsídeos é apoiada por:
Personagem 39 (2). Vazio intertemporal longo, pelo menos 15% do comprimento do crânio. Este caráter é revertido em Procolophon , pareiasaurs e Odontochelys , que têm um vazio interpterygoid mais curto.
Personagem 49 (1). Forame suborbital presente. Isso é transformado em uma fenestra (2) em araeoscelidians, Youngina, Proganochelys e algumas tartarugas-da-coroa. Acleistorhinus perdeu o forame (0).
Personagem 51 (1). Ausência de asas parassenoides.
Personagem 54 (1). Presença de crista anterior supracecipital.
Personagem 55 (2). Placa supra-occipital estreita. O supraoccipital torna-se ainda mais estreito (3) em Procolophon , pareiasaurs e tartarugas, ao passo que se torna mais amplo (1) em Acleistorhinus .
A surpreendente inclusão de para-répteis no menor clado que compreende também os Araeoscelidianos , Youngina e Paleotiris é apoiada por:
Personagem 16 (2). Uma redução no tamanho do tabular, que é ainda mais reduzida no clado que inclui Owenetta, Procolophon , pareiasaurs e tartarugas. Esse caractere é revertido em pareiasauros, que readquirem um tabular maior (estado 1).
Personagem 57 (1). O processo paroccipital contata tabular distalmente. Esse
caráter pode caracterizar um clado mais inclusivo, pois é inaplicável
nos captoríneos, que não possuem um arcabouço e mesossolos, nos quais a
situação é incerta, dadas as informações contraditórias fornecidas por
vários espécimes.
Personagem 119 (1). Carpo e tarso longos e finos (mais globalmente do que largo). Esta é uma sinapomorfia fraca porque, entre os pararépteis, está documentada apenas em millerettids. Esse personagem é invertido no menor clado que inclui Procolophon , pareiasaurs e tartarugas, e não é documentado em Acleistorhinus e Owenetta .
Personagem 126 (1). Metapodiais sobrepostos. Esta é outra sinapomorfia moderadamente convincente, porque entre os pararépteis está documentada em Procolophon e em algumas millerettids ( Thommasen e Carroll, 1981 ). Também está presente nas tartarugas, mas está ausente em pareiasauros e não documentado em Acleistorhinus e Owenetta .
A posição de Paleothyris como grupo-irmão do menor clado que inclui Youngina , para- répteis e tartarugas é apoiada por:
Personagem 89 (1). Arcos neurais do tronco posterior (lombar) estreitos. Isto é invertido (para inchado; 0) em Owenetta, Procolophon e pareiasaurs.
Personagem 90 (1). Os contrafortes zigapofisários do tronco posterior (lombar) se estreitam. Isso
se refere à largura ântero-posterior dos contrafortes, não à largura
dos arcos neurais, que é tipicamente avaliada na visão anterior ou
posterior. Este personagem não tem a mesma distribuição que o anterior, pois não há evidência de reversão no clado.
A igualmente surpreendente posição dos parapépteis como o grupo-irmão de Youngina
é fracamente apoiada com uma frequência bootstrap de 47% e um índice de
Bremer (decaimento) de 3. Enquanto vemos esse resultado com alguma
suspeita e o consideramos provisório, fornecemos uma lista de
sinapomorfias que a suportam. Para mencionar apenas os caracteres que suportam inequivocamente essa topologia, isso inclui:
Personagem 9 (1). O queixoso é excluído do naris e septomaxilla; isto é invertido em millerettids e pareiasaurs.
Personagem 18 (1). Um processo anterodorsal elevado da maxila que atinge o nariz. Isto
é revertido em millerettids (estado 0, processo anterodorsal ausente) e
pareiasauros (estado 1, baixo, processo anterodorsal não atinge nasal).
Note que há um forte elo lógico entre os dois personagens (9 e 18), ambos na matriz de Laurin e Reisz (1995 ; personagens 9 e 18); Para resolver este problema, nós diminuímos o peso de ambos os caracteres para 0.5.
Personagem 24 (1). Dente caniniforme (2) substituído por região caniniforme (1). A
tendência para menos diferenciação no tamanho dos dentes (0) continua
dentro dos para-selos, já que algumas millerettides (0 e 1) e todos os
procolofonídeos e pareiasauros não possuem uma região ou dente
caniniforme (0). Os mesossauros são convergentes em ter uma dentição homodont (0), sob esta topologia.
Personagem 48 (1). Ausência de dentes ectopterygoid.
Personagem 70 (1). Processo dorsal do estapédio não identificado ou ausente.
Personagem 94 (1). Processos transversais presentes em pelo menos 12 vértebras caudais. Este personagem é indocumentado em vários pararptiles ( Acleistorhinus , millerettids, e Owenetta ) e em Odontochelys , então esta sinapomorfia é apenas moderadamente bem estabelecida.
Personagem 101 (1). Supra-renal forame ausente.
Personagem 110 (1). Olecrano processo pequeno, com pequena faceta articular voltada proximalmente. Essa sinapomorfia é apenas moderadamente satisfatória porque não pode ser classificada para Acleistorhinus , millerettids e Owenetta , portanto, a condição na base dos para-répteis é pouco documentada.
Personagem 113 (1). Lâmina ilíaca expandida dorsalmente e distalmente alargada.
Personagem 114 (1). Contraforte acetabular grande, pendendo fortemente. Esta sinapomorfia é mal documentada porque não pode ser classificada para Acleistorhinus , millerettids, Owenetta e Odontochelys .
Subamostragem Taxonômica
Quando
Mesosauridae é deletado da matriz, recuperamos uma filogenia mais
convencional, na qual os pararépteis formam o grupo irmão de eureptiles,
e no qual Paleothyris
é excluído dos diapsídeos. O único resultado não ortodoxo dessa
amostragem taxonômica é que os procolononóides permanecem parafiléticos
em relação aos pareiasauros e tartarugas.
A
exclusão de Chelonii da matriz não altera a topologia da árvore mais
curta, exceto que não há mais uma tricotomia basal das tartarugas. A
robustez da posição dos mesossauros fora do menor clado que inclui todos
os outros sauropsídeos é forte, com um índice de Bremer (decaimento) de
4, e uma frequência de bootstrap de 56%. Na árvore de bootstrap (embora
não na árvore mais parcimoniosa), Paleothyris
está fora de Diapsida.
No entanto, com essa amostra taxonômica, o clado
mais robusto (com um índice de Bremer de 7 e uma freqüência de
bootstrap de 97%) inclui Pareiasauria, Owenetta, Procolophon
e tartarugas-caule. Este continua a ser um dos clados mais robustos,
com um índice de Bremer de 6 e uma frequência de bootstrap de 97%,
quando Proganochelysé
removido (além de Chelonii), enquanto a posição dos mesossauros fora do
clado que inclui os outros sauropsídeos permanece bastante robusta, com
um índice de Bremer de 5 e uma freqüência de bootstrap de 68%. A
remoção adicional de Odontochelys
resulta em duas árvores (comprimento de 291 passos no PAUP). Seu
estrito consenso é compatível com os resultados da amostra taxonômica
completa, mas muito menos resolvido. Os quatro taxa eureptil e
Parareptilia formam uma grande politomia (a Parereptilia permanece
monofilética), e duas tricotomias estão presentes dentro da Parareptilia
(uma com Acleistorhinus , Millerettidae, e um clado incluindo pareiasaurs mais ambos procolonóides, e uma segunda politomia incluindo Owenetta, Procolophon e pareiasauros). ).
Discussão
A posição dos mesossauros fora do clado que inclui todos os outros sauropsídeos, como sugerido por Laurin e Reisz (1995),
parece ser um resultado razoavelmente robusto, embora vários clados
parépteis sejam mais robustos. A freqüência de bootstrap relativamente
baixa (58% para Sauropsida; 66% para o maior clado de sauropsídeos que
exclui mesossauros) não é muito convincente, mas três etapas adicionais
são necessárias para colocar mesossauros em outras partes da árvore e,
nessas árvores alternativas, os mesossauros estão fora Sauropsida; a
posição de grupo-irmão de outros pararóptiles, previamente sugerida por Gauthier et al. (1988) e Modesto (1999),
ou outras posições dentro de pararépteis implicam pelo menos quatro
etapas extras e essas posições alternativas têm frequências de bootstrap
de 12% ou menos. Dada a mistura de características primitivas e
derivadas do esqueleto do mesossauro, os resultados obtidos não são
inesperados. Assim, vários caracteres presentes nos mesossauros são
compartilhados com aqueles presentes em amniotas basais ou parentes
próximos de amniotas (ver acima). Esta colocação de mesossauros na
filogenia amniótica é ligeiramente mais robusta do que em Laurin e Reisz (1995).,
em que o clado que incluía todos os sauropsídeos, exceto os
mesossauros, tinha um índice de Bremer de apenas um, mas uma frequência
de bootstrap similar de 67%. Essa melhora moderada da robustez (pelo
menos como avaliada pelo índice de Bremer) se beneficia de vários novos
estudos anatômicos sobre os mesossauros. Entretanto, as sugestões
anteriores de que os mesossolos são os pararóptiles basais ( Gauthier et al., 1988 ; Modesto, 1999
) não são surpreendentes porque os mesossauros compartilham algumas
características com os procolonóides, como a presença de arcos neurais
inchados e o pós-orbital não atingindo o supratemporal. A frequência de
bootstrap relativamente baixa (66%) presumivelmente reflete uma
quantidade razoável de conflito de caracteres.
A
posição dos pararépteis em nossa árvore, apesar de pouco ortodoxa,
oferece uma possível solução entre duas hipóteses sobre a posição das
tartarugas antes consideradas mutuamente incompatíveis, ou seja, entre
os pararépteis, como sugerem alguns estudos paleontológicos ( Reisz e Laurin, 1991 ; Lee, 1993). , 1996 ; Laurin e Reisz, 1995 ), ou entre diapsídeos como sugerido pela maioria dos recentes molecular ( Hugall et al., 2007 ; Chiari et al., 2012 ) e algumas filogenias paleontológicas ( Rieppel e deBraga, 1996 ; deBraga e Rieppel, 1997 ; Piñeiro de 2004).
A possibilidade de que os pararépteis sejam, na verdade, diapsídeos que
perderam uma ou ambas as fenestrae (a fenestra superior nunca foi
encontrada no grupo), que é levantada pelos nossos resultados, oferece
uma saída para essa controvérsia, já que as tartarugas podem ser ambas
pararópticas e diapsídeos. Sob essa hipótese, o fechamento temporal
superior da fenestra descrito por Bever et al. (2015) na ontogenia do eunotossauro pode, na verdade, caracterizar os parapeitos como um todo. No eunotossauro , esse fechamento é alcançado pela expansão anterior do supratemporal. O supratemporal é razoavelmente grande na maioria dos parapépteis ( deBraga e Reisz, 1996 ; Lee, 1997 ; Reisz e Scott, 2002 ;Tsuji et al., 2012 ), então é possível que eles compartilhem esse mecanismo de fechamento fenestra temporal superior com o eunotossauro
. Essa possibilidade pode ser verificada por meio de tomografia
computadorizada ou preparação mecânica da superfície interna do teto do
crânio. No entanto, a morfologia dos pararópteis basalmost (supondo que
as filogenias recentes estão corretas) não é consistente com este
cenário. Assim, os millerettídeos e o ainda mais antigo e mais basal Microleter e Australothyris estão entre os pararépteis com o menor supratemporal ( Gow, 1972 ; Tsuji et al., 2010).).
Claramente, este subproduto intrigante de nosso estudo sobre as
afinidades dos mesossauros precisará ser avaliado tanto com uma amostra
ampliada de táxons e caracteres, quanto com novos estudos anatômicos da
área temporal da maioria dos paraplépteis. Isso não é feito aqui porque o
objetivo do nosso estudo foi avaliar a posição dos mesossauros na
filogenia amniótica. Avaliar a posição dos pararépteis como um todo, e a
controversa questão das origens das tartarugas são objetivos muito mais
ambiciosos que nosso estudo não foi projetado para avaliar.
A
posição dos pararépteis dentro dos diapsídeos aqui obtidos deve ser
testada ainda mais porque nossa amostra taxonômica de diapsídeos é
esparsa, com apenas dois táxons de diapsídeos de tronco (araeoscelidians
e younginiformes) representados. O fato de que esta topologia não é
recuperada (com pararépteis formando o grupo irmão de eureptiles) quando
Mesosauridae é excluído da matriz reforça ainda mais esta nota de
cautela. Quando os mesossauros são excluídos da análise, os eurepteis
são unidos por seis sinapomorfias (número de caracteres entre
parênteses): contato pós-orbital / supratemporal ausente (12); canto
posterolateral da mesa craniana formado por parietal e supratemporal
pequeno (15); supratemporal pequeno (17); fenestra esquamosal e
póstemporal em contato (25); processo quadrate anterior curto (35); e
flange arqueada de pterigóide ausente (42).O fato de os mesossauros
compartilharem metade desses caracteres (12, 35 e 42) enfraquece o
suporte para Eureptilia. Esta topologia é nova para o nosso
conhecimento, emboraLee (2013)
descobriu, em algumas de suas 12 análises (oito de um conjunto de dados
focados em diapsid e quatro de um conjunto de dados focado no pararéptil ), que o eunotossauro pararéptil , que tem sido reivindicado ser um parente próximo de tartarugas ( Lyson et al., 2010 ; Bever et al., 2015
), cabe dentro dos diapsídeos. No entanto, nossos resultados diferem
(com a amostra taxonômica completa) em colocar todos os pararópteis
dentro dos diapsídeos. Ainda assim, esta nova hipótese é apoiada por
alguns caracteres frequentemente discutidos, como a emarginação
temporal, que está presente na maioria dos pararópteis ( Müller e Tsuji, 2007 ), bem como em coroa-diapsídeos ( Laurin, 1991).)
e tartarugas. Esta parte dos resultados é a mais surpreendente, embora
seja possível que o suporte morfológico para o taxon Eureptilia
(excluindo para-se) seja mais fraco que o comumente realizado. Por
exemplo, na análise de Tsuji et al. (2010)
, a frequência de bootstrap para esse clado é de apenas 58% (uma das
mais baixas da árvore), e a probabilidade bayesiana posterior é de 86%
(maior, mas entre a metade mais fracamente suportada dos clados de sua
árvore). Da mesma forma, na análise de Laurin e Reisz (1995) , Eureptilia teve uma frequência de bootstrap de apenas 69%, o que o colocou entre os clades mais fracamente suportados.
Estranhamente,
Procolophonoidea é encontrado aqui para ser parafilético em relação aos
pareiasauros e tartarugas, apesar do fato de que incluímos uma de suas
sinapomorfias mais óbvias, ou seja, a extensão posterior da órbita
(personagem 37), que Owenetta e Procolophon
são os únicos taxa a exibir em nossa matriz. Este resultado é
moderadamente robusto (frequência bootstrap de 64% e índice Bremer de 5)
e persiste com a deleção de Mesosauridae da análise. No entanto, nós
adicionamos Owenetta sem adicionar sinapomorfias de Procolophonoidea, então este resultado pode ser um artefato.
A posição de Paleothyris
dentro dos diapsídeos é igualmente surpreendente, mas esse resultado
não é robusto e desaparece quando os mesossauros são removidos da
análise. A frequência de bootstrap deste clade (na análise com todos os
taxa) é de apenas 20%, e seu índice de Bremer (decaimento) é apenas 1, o
que significa que apenas mais um caractere suporta esta posição para Paleothyris do
que a posição mais suportada. Esta topologia reflete em parte o fato de
que a posição dos mesossauros na base de Sauropsida torna a presença da
fenestra temporal inferior uma amniota sinapomorfa (invertida em
Captorhinidae, Paleothyrise a maioria dos parabrópicos e tartarugas); A
remoção dos mesossauros altera a história desse personagem na base dos
amniotas, que, por sua vez, sustenta o monofiletismo diapsídico. Além disso, vários estudos têm enfatizado a importância da fenestração como um caráter sistemático ( Fucik, 1991 ; Hamley e Thulborn, 1993 ; Müller, 2003 ; Cisneros et al., 2004 ; Modesto et al., 2009 ; Tsuji et al., 2010 ; Bever et al., 2015 ), e a morfologia temporal pode ser influenciada por vários fatores ( Werneburg, 2012), o que complica a interpretação da morfologia observada. Assim, a questão do monofiletismo diapside (além da inclusão de tartarugas) pode valer a pena investigar mais.
Em
suma, nosso estudo sugere que os mesossauros são os sauropsídeos
basais; esse resultado parece ser bastante bem suportado, pelo menos com
nosso conjunto de dados. Além disso, nossos resultados levantam vários
problemas sobre a filogenia dos primeiros amniotas, alguns dos quais
podem valer a pena re-investigar com uma amostra aumentada de táxon e
caracteres, e um novo olhar sobre vários espécimes. Além de sugerir mais
uma hipótese sobre a origem das tartarugas, nossos resultados ressaltam
a importância da inclusão de mesossauros em análises filogenéticas de
amniotas, pois podem potencialmente alterar a topologia próxima à base
de Amniota e enfraquecer o suporte para Eureptilia e Diapsida. A
inclusão de mesossauros em tais análises não é a prática estabelecida
(por exemplo, Reisz et al., 2011 ; Lyson et al., 2013 ).
Contribuições do autor
Todos os autores listados fizeram uma contribuição substancial, direta e intelectual ao trabalho e o aprovaram para publicação.
Financiamento
Esta pesquisa foi financiada pelo CNRS (subvenção recorrente para o
projeto CR2P e PICS Mesosaur biologia e suas implicações para a evolução
dos primeiros amniotes, projeto número 6326), o Ministério Francês de
Pesquisa, o MNHN (ATM Émergences "Mésosaures: émergence des sauropsides,
de la viviparité, et premiers retours à l'environnement aquatique ”), e
National Geographic Society (concessão número 9497-14,“ A biologia dos
primeiros répteis aquáticos conhecidos ”).
Declaração de conflito de interesse
Os autores declaram que a pesquisa foi realizada na ausência de
quaisquer relações comerciais ou financeiras que possam ser
interpretadas como um potencial conflito de interesses.
Agradecimentos
Gostaríamos de agradecer a Michael SY Lee e Juliana Sterli pelas suas críticas muito construtivas.
Material suplementar
O Material Complementar deste artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/feart.2017.00088/full#supplementary-material
Arquivo aberto HAL ( https://hal.archives-ouvertes.fr/ ) através deste link: https://hal.archives-ouvertes.fr/hal-01618314 .
Referências
Joyce, WG, Parham, JF e Gauthier, JA (2004). Desenvolver
um protocolo para a conversão de nomes de táxons baseados em
classificação em nome de clade filogeneticamente definido, como
exemplificado pelas tartarugas. J. Paleont . 78, 989-1013. doi: 10.1666 / 0022-3360 (2004) 078 <0989: dapftc=""> 2.0.CO;
Palavras-chave: Mesosauridae, Sauropsida, Reptilia, Amniota, Permiano
Citação: Laurin M e Piñeiro GH (2017) Uma reavaliação da posição taxonômica dos mesossauros e uma filogenia surpreendente dos primeiros amniotas. Frente. Earth Sci . 5:88. doi: 10.3389 / feart.2017.00088
Citação: Laurin M e Piñeiro GH (2017) Uma reavaliação da posição taxonômica dos mesossauros e uma filogenia surpreendente dos primeiros amniotas. Frente. Earth Sci . 5:88. doi: 10.3389 / feart.2017.00088
Recebido em 12 de agosto de 2017; Aceito em: 12 de outubro de 2017;
Publicado em: 02 novembro 2017.
Publicado em: 02 novembro 2017.


Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.