Cicatriz umbilical preservada mais antiga revela que dinossauros tinham "umbigos"
BMC Biology volume 20 , número do artigo: 132 ( 2022 )
Resumo
Fundo
Nos amniotas que põem ovos, o embrião em desenvolvimento está preso a várias membranas extraembrionárias, incluindo o saco vitelino e o alantoide, que fornecem oxigênio e nutrientes e removem os resíduos metabólicos ao longo do desenvolvimento embrionário. Antes ou logo após a eclosão, essas membranas se desprendem do animal deixando uma cicatriz umbilical temporária ou permanente (umbigo) equivalente ao umbigo ou 'umbigo' em alguns mamíferos placentários, incluindo humanos. Embora onipresente em mamíferos e répteis modernos (incluindo pássaros), pelo menos no início de sua ontogenia, o umbigo não foi identificado em nenhum amniota pré-cenozoico.
Resultados
Relatamos o umbigo preservado mais antigo em um amniota fóssil de um dinossauro ceratopsiano de aproximadamente 130 milhões de anos, o Psitacossauro . Sob fluorescência estimulada por laser (LSF), o umbigo é revelado como uma estrutura alongada na linha média delimitada por uma fileira de escamas emparelhadas no abdômen. O estágio ontogenético relativamente tardio (próximo da maturidade sexual) estimado para o indivíduo indica que o umbigo provavelmente foi retido por toda a vida.
Conclusões
Ao contrário da maioria dos répteis e pássaros existentes que perdem essa cicatriz dentro de dias a semanas após a eclosão, o umbigo do Psitacossauro persistiu pelo menos até a maturidade sexual, semelhante a alguns lagartos e crocodilianos com os quais compartilha a semelhança morfológica mais próxima. Esta descoberta é o registro mais antigo de um umbigo amniota e o primeiro em um dinossauro não aviário. No entanto, dada a variabilidade dessa estrutura em análogos reptilianos existentes, uma cicatriz umbilical persistente pode não estar presente em todos os dinossauros não aviários.
Fundo
Os amniotas são caracterizados pela presença de várias membranas extraembrionárias (alantoide, âmnio, córion e saco vitelino) e uma casca de ovo semipermeável que fornece um ambiente estável e nutrição para o embrião em desenvolvimento [ 1 , 2 , 3 ]. Duas dessas membranas em particular – o alantoide e o saco vitelino – estão intimamente ligados ao embrião por meio de vasos sanguíneos vitelino e alantoide que penetram na parede abdominal e, em mamíferos placentários, são encerrados dentro de um longo cordão umbilical [ 1 , 2 ]. Imediatamente antes ou logo após a eclosão, esta comunicação é cortada e o saco vitelino é internalizado [ 1 , 2 ], embora a abertura na parede abdominal possa levar vários dias a semanas para fechar completamente, deixando uma cicatriz umbilical ou umbigo [ 3 ] . O descolamento do cordão umbilical do mamífero placentário após o nascimento resulta no umbigo característico ou 'umbigo', que é o equivalente topográfico e de desenvolvimento do umbigo em répteis e aves.
No registro fóssil, tecidos moles excepcionalmente preservados fornecem uma lente inestimável para estudar a aparência, biologia e ecologia de organismos extintos, aumentando os dados de partes duras mais comumente preservadas, incluindo ossos e exoesqueletos [ 4 , 5 ]. Um indivíduo quase completo do Psitacossauro ceratopsiano de ramificação inicial ( SMF R 4970, alojado no Instituto de Pesquisa Senckenberg e Museu de História Natural de Frankfurt, Frankfurt, Alemanha) do Grupo Jehol do Cretáceo Inferior da Província de Liaoning, China [ 6 ] é um exemplo de os insights notáveis que os tecidos moles de dinossauros excepcionalmente preservados revelaram. O indivíduo em SMF R 4970 é preservado deitadlepidossauroo de costas e é quase totalmente envolto pelo tegumento preservado, incluindo escamas epidérmicas, o 'chifre' queratinoso jugal e uma longa pluma de cerdas da cauda [ 6 , 7 ]. A preservação excepcional também permitiu a identificação prévia de sua cloaca - a primeira ocorrência em um dinossauro não aviário [ 8 ] - bem como padrões de pigmentação da pele e evidências de contra-sombreamento em todo o corpo 9 ]. Aqui, documentamos a anatomia da cicatriz umbilical do espécime SMF R 4970, que é recentemente identificado aqui com base no estudo em primeira mão do espécime sob imagens de fluorescência estimulada por laser (LSF) e um levantamento de cicatrizes umbilicais em lepidossauros e arcossauros.
Resultados
escamas no Psitacossauro são fortemente regionalizadas em todo o corpo. Aspectos disso foram descritos em SMF R 4970 anteriormente [ 6 , 8 , 9 , 10 ], e uma descrição completa do tegumento de SMF R 4970 será dada pelos autores em outro lugar. Aqui, resumimos esses estudos e nossas próprias observações. A cintura peitoral e os membros são cobertos por escamas de porão tipicamente pequenas (
diâmetro = 1,2 mm) e ovóide na face plantar dos pedestais. A cauda (excluindo a cloaca e a calosidade isquiática) consiste em faixas verticais (orientadas mediolateralmente em vida) de escamas tipicamente arredondado-quadrangulares que variam de 1,7 a 3,3 mm de altura e geralmente aumentam de tamanho posteriormente.
A iluminação do espécime sob LSF revela os padrões de escamação em detalhes extraordinários e permite a identificação de escamas individuais [ 7 , 9 ]. Em particular, as partes inferiores moles do animal, entre a caixa torácica e estendendo-se posteriormente entre os ísquios, são cobertas por pequenas (
comprimento = 1,4 mm) escamas quadrangulares dispostas em 'faixas' transversais distintas como é típico de crocodilianos modernos e alguns escamados (por exemplo, lagartos de cauda espinhosa Uromastix spp.; Figs. 1 e 2 ). No SMF R 4970, essa bandagem transversal é restrita ao abdome mole, bem como à superfície ventral da cauda, embora as escamas quadrangulares ali sejam bem maiores (até 3,3 mm de altura dorsoventral). Estendendo-se anteriormente da calosidade isquiática [ 7 , 9 ], as bandas transversais são quebradas ao longo da linha média ventral do animal por uma distinta fileira longitudinal de escamas quadrangulares pareadas (Fig. 1 ). Essas escalas pareadas geralmente são maiores (comprimento = 2,5 mm; arquivo adicional 1 : Tabela S1) ou de tamanho semelhante às escamas abdominais circundantes, uniformemente distribuídas com margens regulares e superfícies superiores, e estendem-se em uma linha desde a frente da sínfise isquiádica anteriormente por ~13 cm, equivalente a ~14% da comprimento focinho-ventilação (SVL = 74 cm). O tecido intersticial entre as escamas pareadas forma uma característica linear óbvia, mesmo onde as escamas pareadas combinam mais com o tamanho e a forma das escamas abdominais restantes (por exemplo, na parte anterior da estrutura da linha média; veja a metade superior da imagem na Fig. . 1B ,C) Uma demarcação linear tão clara (anteroposterior) entre escamas não está presente em nenhum outro lugar do espécime. Não há indicação de enrugamento ou sobreposição de escamas nesta parte do abdome que sugira distorção tafonômica ou outra da pele. O enrugamento do tegumento está presente em outras partes do corpo, como a cloaca e os membros. Estes invariavelmente mostram escalas que são truncadas ou distorcidas (como resultado da projeção bidimensional da superfície originalmente curvada e dobrada) e têm limites nítidos e conspícuos onde o tegumento está sobreposto. Em contraste, a parte posterior da pele abdominal parece tensa, sem evidência de enrugamento, exceto onde encontra os membros posteriores, que estão distantes da linha média (Fig. 2A ). O tecido intersticial entre as escamas quadrangulares pareadas e entre as escamas abdominais circundantes é uniformemente estreito sem evidência de estiramento, nem há evidência de distorção, truncamento ou limites conspícuos indicativos de dobras/enrugamento da pele.
Cicatriz umbilical em Psitacossauro SMF R 4970 sob LSF . Uma imagem recortada de Psittacosaurus sp. (SMF R 4970) mostrando apenas os contornos do esqueleto e tecidos moles, com a cicatriz umbilical destacada pela linha amarela tracejada. B Close da região do box em ( A ) com a extensão anteroposterior máxima da cicatriz umbilical indicada pelas pontas de seta. O enrugamento formando vincos ondulados irregulares no tegumento pode ser visto na extrema direita desta imagem, onde o abdome encontra a parte interna da coxa; C , D Close da região do box em ( B ) mostrando escamas quadrangulares pareadas (contorno azul em D ) delimitando o umbigo. A banda transversal é visível nas restantes escamas abdominais (contornos pretos em D ). E Close de escalas quadrangulares pareadas (ps). Uma linha clara de tecido intersticial, delimitando a cicatriz anterior, pode ser vista entre as escamas pareadas. Anterior é para o topo em ( B - E ). Barras de escala são iguais a 5 mm ( B – D ) e 2 mm ( E )
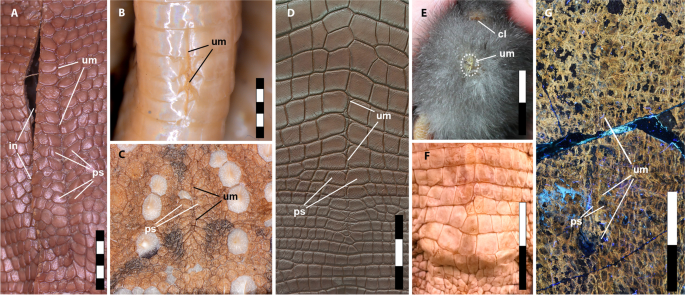
Cicatrizes umbilicais em répteis modernos, pássaros e psitacossauros. Uromastix Lagarto de cauda espinhosa ( sp .), adulto, comprimento focinho-cloalha (SNV) = 168 mm; B cobra marrom oriental ( Pseudonaja textilis ), filhote, SNV = 239 mm; C diabo espinhoso ( Moloch horridus ), adulto, SNV = 95 mm; D crocodilo de água doce ( Crocodylus johnsoni ), idade desconhecida (foto: Ohmega1982/ Shutterstock.com ); E galinha doméstica ( Gallus gallus domesticus ), pintinho de 3 dias (foto: A. Moss, usado com permissão); F crocodilo de água doce ( Crocodylus johnsoni ) sem cicatriz umbilical, filhote, SNV = 288 mm; G Psitacossauro SMF R 4970. A – F Sob luz branca e G sob LSF. Abreviaturas: cl, cloaca; in, incisão feita durante a dissecção; ps, escamas umbilicais pareadas; hum, umbigo. Barras de escala iguais a 5 mm ( A – C ) e 3 cm ( D – E )
A análise histológica não será permitida pelo museu devido à raridade e natureza histórica do espécime. Assim, utilizamos o comprimento do fêmur para estimar a idade do indivíduo. O fêmur direito do SMF R 4970 tem ~ 140 mm de comprimento, o que é semelhante aos comprimentos femorais de P. lujiatunensis IVPP V12617 (138 mm) e IVPP V18344 (145 mm), LPM R00128 (135 mm) e R00138 (144 mm), PKUVP V1053 (149 mm) ) e IVPP V1056 (135mm), que todos pertencem a subadultos de ~6-7 anos de idade (ver Tabela 1 e Fig. 5 de Erickson et al. [ 11 ] e Tabela suplementar S2 de Zhao et al. [ 12 ] ). Esta idade é pouco antes da maturidade sexual e no início da fase de crescimento exponencial (ver tabela 1 e fig. 5 de Erickson et al . [ 11 ] e tabela suplementar S2 de Zhao et al . [ 12 ]). O comprimento femoral de SMF R 4970 é, portanto, o mais próximo de um subadulto sexualmente maduro (ver tabela 1 e fig. 5 de Erickson et al. [ 11 ] e tabela suplementar S2 de Zhao et al. [ 12 ]).
Discussão
A estrutura da linha média em SMF R 4970 consistindo de escamas pareadas tem a forma e a posição restrita à parte posterior do abdome compatível com a morfologia do umbigo (cicatriz umbilical) em amniotas existentes. Ao contrário da maioria dos mamíferos, os répteis (incluindo pássaros) não possuem um cordão umbilical verdadeiro – que é uma estrutura alongada derivada do alantoide que liga a placenta e o embrião [ 13 ]. Em vez disso, o embrião reptiliano está em comunicação direta com o saco vitelino e o alantoide (ou membrana corioalantoide [ 14 ]) através de uma abertura longitudinal na linha média na parede abdominal. Essa abertura se fecha para formar o umbigo, que, na maioria dos répteis existentes (incluindo pássaros), persiste por apenas alguns dias a semanas e, portanto, é um indicador comum da maturidade relativa de um indivíduo (por exemplo, [ 15 , 16 , 17 ]) . Em aves embrionárias em estágio avançado, o umbigo forma uma abertura circular na parede abdominal que é reduzida a uma pequena crosta circular que normalmente cai alguns dias após a eclosão (Fig. 2E ; Arquivo adicional 1 : Tabela S1; veja também a Fig. 5 em Kenny e Cambre [ 18 ]). Embora a cicatrização não ocorra normalmente, pode persistir em algumas aves adultas (por exemplo, pombo rochoso, Columba livia [ 19 ]) como uma cicatriz linear na parede abdominal inferior [ 19 ]. As cicatrizes em lepidossauros (cobras e lagartos) não são óbvias devido à presença de escamas; no entanto, a posição do umbigo nos adultos de algumas espécies de serpentes é mantida como uma linha tênue ou prega nas escamas ventrais [ 15 ] (Fig. 2 B; Arquivo adicional 1 : Tabela S2). Em lagartos, as cicatrizes geralmente estão ausentes, mas o umbigo pode ser demarcado e claramente reconhecido por uma mudança na morfologia da escama abdominal. Isso geralmente é refletido como uma fileira longitudinal de escamas pareadas que geralmente são maiores e de forma diferente das escamas abdominais circundantes e que permanecem visíveis ao longo da vida, muito semelhante à condição do Psitacossauro (Fig. 2 ; Arquivo adicional 1 : Tabela S2 ). Entre as escamas pareadas, uma linha clara de tecido intersticial delimita a linha média e a antiga abertura umbilical (Fig. 2 A), que é observável também no Psitacossauro , mesmo onde as escamas emparelhadas correspondem mais de perto ao tamanho e forma das escamas abdominais circundantes (Fig. 1 B, C). Uma linha tão distinta de tecido intersticial não é visível em nenhum outro lugar no abdômen de SMF R 4970. Onde eles ocorrem em lagartos modernos, as fileiras de escamas pareadas geralmente são características moderadamente longas e lineares (aprox. 7% de SNV; Arquivo adicional 1 : Tabela S2), embora também tenhamos observado alguns até 11% do comprimento total do focinho-cloalha (SVL) (por exemplo, lagarto de cauda espinhosa, Uromastix sp.; Fig. 2 A; Arquivo adicional 1 : Tabela S2)— que é semelhante em tamanho ao do SMF R 4970 (14% do SNV) e às aves embrionárias em estágio avançado (aprox. 13% do SNV; Arquivo adicional 1 : Tabela S2). Esses valores contrastam com o umbigo relativamente mais curto em serpentes (aprox. 2% do SNV; Arquivo adicional 1 : Tabela S2), que é influenciado pelo alongamento da região do tronco. Entre os crocodilianos, o umbigo geralmente está ausente em adultos, mas permanece distinto em Alligator mississippiensis , formando um arranjo alongado, semelhante a uma teia de aranha, de pequenas escamas entre as bandas transversais de escamas quadrangulares maiores [ 20 ]. Este arranjo é único para Alligator mississippiensis [ 20 ] embora esteja variavelmente presente em outros crocodilianos como uma linha mais suave em alguns indivíduos com ou sem escamas pareadas marginais (Fig. 2 D). Tanto em crocodilianos quanto em lepidossauros que perdem o umbigo, o padrão de escamas abdominais permanece inalterado ao longo da linha média (Figs. 2 F e 3 ). Com base na estreita semelhança estrutural e topográfica, particularmente com alguns crocodilianos e escamados, interpretamos a estrutura da linha média ventral em Psittacosaurus SMF R 4970 como delimitando o umbigo, que permaneceu visível por muitos anos, pelo menos na maturidade sexual (6+ anos).
Variação na cicatriz umbilical em lagartos existentes. Escamas abdominais ininterruptas sem cicatriz umbilical em ( A ). O lagarto de língua azul ( Tiliqua scincoides ) e B a tainha da terra ( Bellatorias major ). Umbigo mal demarcado (pontos finais indicados por pontas de seta) sem escamas pareadas distintas em ( C ). O dragão barbudo ( Pogona barbata ) e D o dragão de água oriental ( Amphibolurus barbartus ). Anterior está em alta em todas as imagens. Incrementos da barra de escala em centímetros
Quando presente, a persistência da cicatriz umbilical na idade adulta entre répteis e aves pode ser espécie-específica e sua posição até sexualmente dimórfica em alguns casos [ 15 ]. A cicatrização também pode estar ligada a infecções do saco vitelino (onfalite) em aves de criação e crocodilianos, que está ligada a condições inadequadas pré ou pós-eclosão (por exemplo, higiene, dieta, desequilíbrio de temperatura/umidade), embora essas condições adversas raramente estejam presentes na natureza [ 21 , 22 ]. Portanto, a presença de uma cicatriz umbilical em Psittacosaurus não implica sua presença em indivíduos maduros (ou quase maduros) de todas as espécies de dinossauros não aviários, embora não possamos rejeitar essa possibilidade neste momento.
Os tamanhos regulares, margens lisas e disposição das escamas umbilicais ao longo da linha média do Psitacossauro - que é semelhante aos répteis capturados na natureza (arquivo adicional 1 : Tabela S2) - bem como a ausência de tecido regenerativo, todos descartam uma origem traumática ou patológica [ 21 ]. Por causa da maneira aleatória em que são infligidas, as lesões traumáticas, em contraste, podem truncar/dividir escamas individuais e cicatrizar formando tecido de granulação – um tipo de tecido conjuntivo liso e sem escamas – sobre a ferida aberta [ 23 , 24 , 25 ]. Nos répteis, as escamas podem não crescer novamente, deixando uma região central da derme lisa que pode ser cercada por uma região rompida de escamas pequenas e irregulares que diferem das escamas 'normais' circundantes [ 23 , 24 ]. Tecido de granulação induzido por trauma cercado por um anel de escamas rompidas foi relatado na pele de pelo menos um dinossauro [ 26 ], mas nenhuma dessas características características são observáveis em SMF R 4970.
Remanescentes dos tecidos moles associados à embriogênese e desenvolvimento pós-eclosão precoce (incluindo o umbigo) raramente são capturados no registro fóssil. Até onde sabemos, uma cicatriz umbilical não foi relatada anteriormente em nenhum amniota fóssil [ 27 ], embora o 'cordão umbilical' tenha sido descrito em um peixe placoderme vivíparo de idade Devoniana [ 28 ]. A pele embrionária foi relatada em apenas dois dinossauros não-aviários [ 29 , 30 , 31 ], nenhum dos quais mostra indícios de um umbigo embrionário, e poucos outros espécimes preservam tegumento nu nesta região do abdômen que pode ser comparado com SMF R 4970. Dois espécimes únicos que o fazem - o hadrossaurídeo Edmontosaurus annectens 'múmia' AMNH FARB 5060 e o jovem anquilossauro Liaoningosaurus paradoxus IVPP V12560 - não mostram nenhuma indicação de qualquer estrutura que possa ser interpretada como um umbigo, mesmo que este último tenha menos de um ano idade no momento da morte [ 32 ]. A pele do Liaoningosaurus [ 33 ], no entanto, não cruza perfeitamente com a linha média do animal e o umbigo, se presente, pode simplesmente não ter sido preservado. A fileira linear de escamas quadrangulares pareadas em um titanossauro embrionário da famosa localidade de Auca Mahuevo é de uma posição desconhecida no corpo que se presume estar ao longo da linha média dorsal [ 30 ]. Embora uma posição na linha média ventral também seja sustentável, uma origem umbilical para essa estrutura nos titanossauros Auca Mahuevo pode ser rejeitada, pois os animais ainda estavam em ovo , durante o qual a abertura abdominal ainda estaria aberta.
Conclusões
O notável espécime Senckenberg de Psittacosaurus sp. (SMF R 4970) foi relatado pela primeira vez em 2002 e continua a produzir detalhes surpreendentes que foram fundamentais para a reconstrução dos tecidos moles dos dinossauros. Acrescentamos a esses detalhes nossa identificação da cicatriz umbilical, que é a primeira relatada em dinossauros não aviários e o registro mais antigo dessa estrutura em qualquer amniota fóssil. No Psitacossauro, a cicatriz umbilical é reconhecida por um arranjo linear distinto de escamas abdominais pareadas que circundam o antigo local de fixação do saco vitelino. Essa configuração é consistente com o umbigo de alguns répteis modernos (lagartos e crocodilianos), mas difere morfologicamente daquelas de cobras e pássaros, que não possuem escamas emparelhadas ou não possuem escamas completamente. Enquanto a cicatriz umbilical é normalmente perdida dentro de dias a semanas em répteis e aves existentes, a cicatriz persistente na idade adulta pode ser específica da espécie ou o resultado de variação individual. Esta descoberta fornece informações diretas sobre a fisiologia embrionária e o desenvolvimento de um dinossauro não aviário depois que sua conexão com o saco vitelino foi cortada.
Métodos
Fluorescência estimulada por laser (LSF)
O espécime SMF R 4970 foi examinado em primeira mão e fotografado por MP e TGK em 2016 usando uma versão atualizada da metodologia proposta por Kaye et al. [ 34 ] e refinado em Wang et al. [ 35 ]. Um diodo laser de 405 nm violeta próximo ao UV foi usado para fluorescer a amostra seguindo o protocolo padrão de segurança do laser. As imagens de longa exposição foram tiradas com uma câmera DSLR Nikon D810 equipada com um filtro de bloqueio de 425 nm e controlada a partir de um laptop usando digiCamControl . O pós-processamento da imagem (equalização, saturação e equilíbrio de cores) foi realizado de maneira uniforme em todo o campo de visão no Adobe Photoshop CS6. Como os contornos de tecidos moles no SMF R 4970 são mais bem visíveis usando LSF, as observações feitas usando essa técnica e as imagens digitais resultantes formaram a base para as descrições deste estudo. Todas as medidas foram feitas usando imagens digitais carregadas e calibradas no ImageJ v1.52q.
Comparative specimens
For comparison with SMF R 4970, a representative sample of snakes, lizards, birds and crocodylians were observed in the collections of the University of New England’s Natural History Museum (Armidale, Australia) (see Additional file 1: Table S2) and supplemented by the primary literature. Additional avian umbilicus observations were made on privately owned domestic chickens. Specimens were photographed using an Olympus S7X7 stereomicroscope fitted with an Olympus SC50 digital camera. Multifocal image stacks were manually captured using cellSens Standard (www.olympus-lifescience.com) imaging software and stacked in Adobe Photoshop CC 2019.
Disponibilidade de dados e materiais
Psitacossauro sp. o espécime SMF R 4970 está em exibição pública na exposição permanente Dinosaurs Unlimited no Senckenberg Research Institute e no Museu de História Natural Frankfurt, Frankfurt, Alemanha (Forschungsinstitut Senckenberg, Frankfurt am Main, Alemanha). Há um debate em curso sobre a propriedade legal deste espécime e os esforços para repatriá-lo para a China não foram bem sucedidos [ 36 ]. Nossa equipe internacional de membros australianos, belgas, britânicos, chineses e americanos esperam e apoiam uma solução amigável para este debate em andamento. Achamos importante notar que o espécime foi adquirido pelo Museu Senckenberg para evitar sua venda a particulares e garantir sua disponibilidade para estudo científico [ 6 ]. O espécime está atualmente inventariado como SMF R 4970 na coleção do museu e permanece disponível para pesquisadores qualificados para estudo científico [ 6 ].
Os conjuntos de dados que suportam as conclusões deste artigo estão incluídos no artigo e no arquivo adicional 1 .
Referências
Blackburn DG. Placentação corioalantóica em répteis escamados: estrutura, função, desenvolvimento e evolução. J Exp Zool. 1993;266:414-30. https://doi.org/10.1002/jez.1402660508 .
Stewart JR, Thompson MB. Desenvolvimento do saco vitelino em lagartos (Lacertilia: Scincidae): novas perspectivas sobre o ovo de amniotas. J Morfol. 2017;278:574–91. https://doi.org/10.1002/jmor.20656 .
Pezaro N, Doody JS, Green B, Thompson MB. Eclosão e internalização residual da gema em lagartos: evolução, função e destino do âmnio. Evol Dev. 2013;15:87–95. https://doi.org/10.1111/ede.12019 .
Schweitzer MH. Preservação de tecidos moles em vertebrados mesozóicos terrestres. Annu Rev Earth Planet Sci. 2011;39:187–216. https://doi.org/10.1146/annurev-earth-040610-133502 .
Parry LA, Smithwick F, Nordén KK, Saitta ET, Lozano-Fernandez J, Tanner AR, et al. Fósseis de corpo mole não são simplesmente carcaças podres – em direção a uma compreensão holística da preservação de fósseis excepcional. Bioensaios. 2018;40:1700167. https://doi.org/10.1002/bies.201700167 .
Mayr G, Peters SD, Plodowski G, Vogel O. Estruturas tegumentares semelhantes a cerdas na cauda do dinossauro com chifres Psitacossauro . Naturwissenschaften. 2002;89:361–5. https://doi.org/10.1007/s00114-002-0339-6 .
Mayr G, Pittman M, Saitta E, Kaye TG, Vinther J. Estrutura e homologia de Psitacossauro cerdas de cauda Paleontologia. 2016;59:793–802. https://doi.org/10.1111/pala.12257 .
Vinther J, Nicholls R, Kelly DA. Uma abertura cloacal em um dinossauro não-aviário. Curr Biol. 2021;31:R182–3. https://doi.org/10.1016/j.cub.2020.12.039 .
Vinther J, Nicholls R, Lautenschlager S, Pittman M, Kaye TG, Rayfield E, et al. Camuflagem 3D em um dinossauro ornitísquio. Curr Biol. 2016;26:2456–62. https://doi.org/10.1016/j.cub.2016.06.065 .
Lingham-Soliar T, Plodowski G. The integument of Psittacosaurus from Liaoning Province, China: taphonomy, epidermal patterns and color of a ceratopsian dinosaur. Naturwissenschaften. 2010;97:479–86. https://doi.org/10.1007/s00114-010-0661-3.
Erickson GM, Makovicky PJ, Inouye BD, Zhou CF, Gao KQ. Uma tabela de vida para Psittacosaurus lujiatunensis : insights iniciais sobre a biologia populacional de dinossauros ornitísquios. Anat Rec. 2009;292:1514–21. https://doi.org/10.1002/ar.20992 .
Zhao Q, Benton MJ, Sullivan C, Sander MP, Xu X. Histologia e mudança postural durante o crescimento do dinossauro ceratopsiano Psittacosaurus lujiatunensis . Nat Comun. 2013;4:2079. https://doi.org/10.1038/ncomms3079 Nature Publishing Group.
Inman KE, Downs KM. O alantoide murino: paradigmas emergentes no desenvolvimento do cordão umbilical de mamíferos e sua relação com o feto. gênese. 2007;45:237–58. https://doi.org/10.1002/dvg.20281 .
Dzialowski EM, Sirsat T, van der Sterren S, Villamor E. Derivações cardiovasculares pré-natais em vertebrados amnióticos. Respir Physiol Neurobiol. 2011;178:66–74. https://doi.org/10.1016/j.resp.2011.04.007 .
Richmond ND. Variação e dimorfismo sexual em filhotes da cobra arco-íris, Abastor erythrogrammus . Copeia. 1954; 1954: 87-92. https://doi.org/10.2307/1440324 American Society of Ichthyologists and Herpetologists (ASIH), Allen Press.
Craig J, Shine R. Estratégias de história de vida de lagartos australianos: uma comparação entre os trópicos e a zona temperada. Oecologia. 1988;75:307–16. https://doi.org/10.1007/BF00378615 .
Braña F. Dimorfismo sexual em lagartos lacertídeos: aumento da cabeça do macho versus aumento do abdômen da fêmea? Oikos JSTOR. 1996;75:511–23.
Kenny D, Cambre RC. Indicações e técnica para a remoção cirúrgica do saco vitelino aviário. J Zoo Wildl Med. 1992;23:55–61 Associação Americana de Veterinários de Zoológicos.
Lucas AM, Stettenheim PR. Anatomia aviária: tegumento. 1ª edição. EUA: Departamento de Agricultura; 1972.
Charette R. Guia de identificação CITES – Crocodilianos: guia para a identificação de espécies de crocodilos controladas sob a convenção de comércio internacional de espécies ameaçadas de fauna e flora selvagens. Ottawa: Meio Ambiente Canadá; 1995.
Huchzermeyer FW. Crocodilos: biologia, criação e doenças. Wallingford: CABI; 2003.
Glatz PC, Miao ZH, Glatz PC, Miao ZH. Criação de ratites e potenciais problemas de bem-estar: uma revisão. Aust J Exp Agric. 2008;48:1257–65. https://doi.org/10.1071/EA08136 CSIRO PUBLISHING.
Smith DA, Barker IK. Cicatrização de feridas cutâneas na cobra jarreteira ( Thamnophis sirtalis ). Pode J Vet Res. 1988;52:111–9.
Maderson PFA, Baranowitz S, Roth SI. Um estudo histológico da resposta a longo prazo ao trauma do tegumento escamado. J Morfol. 1978;157:121-35. https://doi.org/10.1002/jmor.1051570202 .
Burke HF, Swaim SF, Amalsadvala T. Revisão do tratamento de feridas em aves de rapina. avms. Veterinário Aviário Assoc. 2002;16:180–91. https://doi.org/10.1647/1082-6742(2002)016[0180:ROWMIR]2.0.CO;2 .
Rothschild BM, Depalma R. Patologia da pele no Cretáceo: evidência de provável falha de predação em um dinossauro. Res. Cretáceo. 2013;42:44–7. https://doi.org/10.1016/j.cretres.2013.01.005 .
Sánchez-Villagra M. Embriões em tempo profundo: o registro rochoso do desenvolvimento biológico. Berkeley, Los Angeles, Londres: University of California Press; 2012.
Long JA, Trinajstic K, Young GC, Senden T. Nascido vivo no período Devoniano. Natureza. 2008;453:650–2. https://doi.org/10.1038/nature06966 .
Chiappe LM, Coria RA, Dingus L, Jackson F, Chinsamy A, Fox M. Embriões de dinossauros saurópodes do Cretáceo Superior da Patagônia. Natureza. 1998;396:258-61. https://doi.org/10.1038/24370 .
Coria RA, Chiappe LM. Pele embrionária de saurópodes do Cretáceo Superior (Dinosauria) de Auca Mahuevo, Patagônia, Argentina. J Paleo. 2007;81:1528–32. https://doi.org/10.1666/05-150.1 .
Hendrickx C, Bell PR, Pittman M, Milner ARC, Cuesta E, O'Connor J, et al. Morfologia e distribuição de escamas, ossificações dérmicas e outras estruturas tegumentares não-penas em dinossauros terópodes não-aviários. Biol Rev. 2022;n/a:1–45. https://doi.org/10.1111/brv.12829 .
Xu X, Wang XL, você HL. Um anquilossauro juvenil da China. Naturwissenschaften. 2001;88:297–300. https://doi.org/10.1007/s001140100233 .
Arbor VM, Burns ME, Bell PR, Currie PJ. Estruturas tegumentares epidérmicas e dérmicas de dinossauros anquilossauros. J Morfol. 2014;275:39–50. https://doi.org/10.1002/jmor.20194 .
Kaye TG, Falk AR, Pittman M, Sereno PC, Martin LD, Burnham DA, et al. Fluorescência estimulada por laser em Paleontologia. PLO UM. Biblioteca Pública de. Ciência. 2015;10:e0125923. https://doi.org/10.1371/journal.pone.0125923 .
Wang X, Pittman M, Zheng X, Kaye TG, Falk AR, Hartman SA, et al. Anatomia funcional paraviana basal iluminada por contorno corporal de alto detalhe. Nat Comun. 2017;8:14576. https://doi.org/10.1038/ncomms14576 .
Dalton R. Fóssil chinês errante aparece em museu. Natureza. 2001;414:571. https://doi.org/10.1038/414571a Nature Publishing Group.
Acknowledgements
R. Brocke kindly granted study access to Psittacosaurus sp. (SMF R 4970) at the Senckenberg Research Institute and Natural History Museum Frankfurt. We thank G. Mayr, R. Brocke and O. Vogel for providing assistance at the museum and information about the specimen; K. Vernes and S. Watson (UNE) for access to comparative collections; A. Prieto-Marquez (Catalan Institute of Paleontology Miquel Crusafont) and V. Arbour (RBCM) for sharing photos of the skin of Edmontosaurus and Liaoningosaurus, respectively; A. Moss (UNE) for providing the photo in Fig. 2E; and P. Freitas Gerber, J. Long, A. Watanabe, and A. Bhullar for discussions. Helpful comments from three anonymous reviewers and M. Kvajo (Editor) improved the final version of this paper.
Financiamento
CH é apoiado pelo Conselho Nacional de Pesquisa Científica e Técnica (CONICET) e Agência Nacional de Promoção Científica e Tecnológica, Argentina (Pós-doutorado CONICET Legajo Fellowship 181417). MP é apoiado pela Escola de Ciências da Vida, Universidade Chinesa de Hong Kong. O TGK é apoiado pela Fundação para o Avanço Científico.
Informação sobre o autor
Autores e Afiliações
Contribuições
Conceituação: PRB e CH; Metodologia: MP, TGK e PRB; Investigação: PRB, CH e MP; Recursos: MP e TGK; Redação—rascunho original: PRB; Redação—revisão e edição: PRB, CH, MP e TGK; Visualização: MP, TGK, PRB e CH; aquisição de financiamento: CH, MP e TGK Os autores leram e aprovaram o manuscrito final.
Autores correspondentes
Declarações de ética
Aprovação ética e consentimento para participar
Não aplicável.
Consentimento para publicação
Não aplicável.
Interesses competitivos
Os autores declaram não ter interesses conflitantes.
Informação adicional
Nota do editor
A Springer Nature permanece neutra em relação a reivindicações jurisdicionais em mapas publicados e afiliações institucionais.
Informação suplementar
Arquivo adicional 1: TabelaS1
. Medidas de escala selecionadas tiradas do abdômen de Psitacossauro SMF R4970. TabelaS2 . Observações e medições de cicatrizes umbilicais em cobras, lagartos, crocodilianos e pássaros representativos existentes.
Direitos e permissões
Acesso Aberto Este artigo está licenciado sob uma Licença Creative Commons Atribuição 4.0 Internacional, que permite o uso, compartilhamento, adaptação, distribuição e reprodução em qualquer meio ou formato, desde que você dê os devidos créditos ao(s) autor(es) original(is) e à fonte, fornecer um link para a licença Creative Commons e indicar se foram feitas alterações. As imagens ou outro material de terceiros neste artigo estão incluídos na licença Creative Commons do artigo, a menos que indicado de outra forma em uma linha de crédito para o material. Se o material não estiver incluído na licença Creative Commons do artigo e seu uso pretendido não for permitido por regulamentação legal ou exceder o uso permitido, você precisará obter permissão diretamente do detentor dos direitos autorais. Para visualizar uma cópia desta licença, visite http://creativecommons.org/licenses/by/4.0/ . A isenção de Dedicação de Domínio Público Creative Commons ( http://creativecommons.org/publicdomain/zero/1.0/ ) aplica-se aos dados disponibilizados neste artigo, salvo indicação em contrário em uma linha de crédito aos dados.


Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.